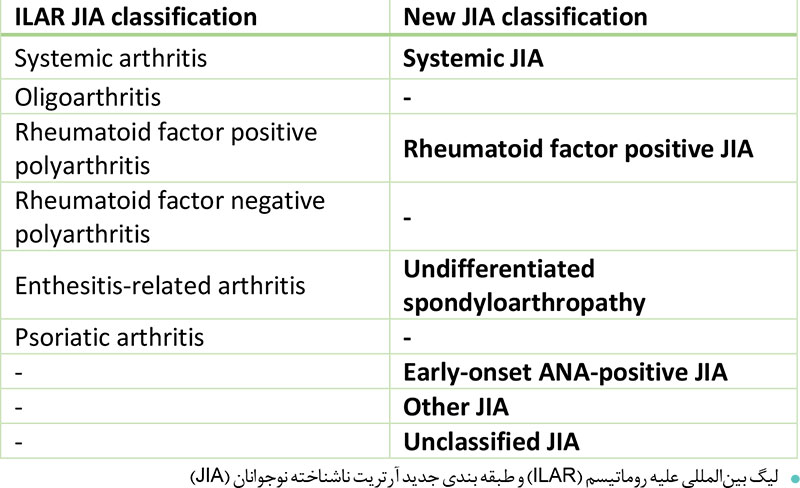
آرتریـت ناشـناختۀ نوجوانـان(JIA،)نـام گروهی از شـرایط اسـت که شـامل همه انـواع آرتروز بـا علـت ناشـناخته ای میشـود کـه حداقـل شـش هفته طـول بکشـد و شـروع آن قبـل از شانزده سـالگی باشـد. ایـن تشـخیص بـه دلیـل نداشـتن ویژگـی ای بالینـی یا آزمایشـگاهی پاتوگونومیـک واحـد، هنوز بالینی اسـت. بر اسـاس طبقه بندی لیگ بین المللـی علیه روماتیس (ILAR ) (جـدول۱)که شـش گـروه مختلف JIA را تشـخیص میدهـد ویژگی های آنها در شـش مـاه اول بیمـاری بـروز میکنـد ؛ اگرچه اخیرا ـطبقه بنـدی جدیدی، ارائه شـده اسـت.
 درواقــع درمان JIA به لطف وجود شــبکه های همکاری بسیار گسترده در بیست سال گذشته به طرز چشــم گیری بهبود یافته است.
درواقــع درمان JIA به لطف وجود شــبکه های همکاری بسیار گسترده در بیست سال گذشته به طرز چشــم گیری بهبود یافته است.
برخی از این شبکه های همکاری به شرح ذیل است:
آزمایشــگاه بینالمللی روماتولــوژی کودکان (PRINTO)؛ گــروه مطالعــات مشــترک روماتیولوژی کودکان (PRCSG)؛ در دسترس بودن داروهای جدید قوی، به ویژه داروهای ضد روماتیکی اصلاح کننده بیماری های بیولوژیکی (DMARDs).
درمان های رایج
تزریــق داخــل مفصلــی (اســتروئیدی(IAI ) تریامسینولون هگزااستونید یا متیل پردنیزولون اســتات)، اســتروئیدهای سیســتمیک و متوترکسات (MTX )برای سالها نقش عمده ای در درمان JIA داشــته اند. آزمایشی اخیرا تأییدکرده اســت که با تزریق همزمان متوترکسات اثربخشــی تزریق اســتروئیدی داخل مفصلی افزایــش نمی یابــد؛ باوجودایــن، پیش آگهی بیماران JIA در دهه های گذشته به لطف معرفی داروهای بیولوژیکــی در ابتدای دهه 2000 ،به طرز چشــمگیری تغییر کرده است. این داروها نشان داده اند در تعداد درخور توجهی از بیماران مقاوم بــه MTX یا آنهایی کــه MTX را تحمل نمی کنند، مؤثر هســتند؛ اگرچه MTX به دلیل اثربخشــی آن در دســتیابی به کنترل بیماری اثرات ســمی پذیرفتنی آن، در دسترس بودن در سراسر جهان و کم هزینه بودن، مرسوم ترین درمان مرسوم در مدیریت JIA است. ازلحاظ بیولوژیک، در حــال حاضر پنج داروی ضد فاکتور نکروزدهنده تومــور (TNF )در JIA موجود اســت. چهار دارو با نتایج منتشــر شده
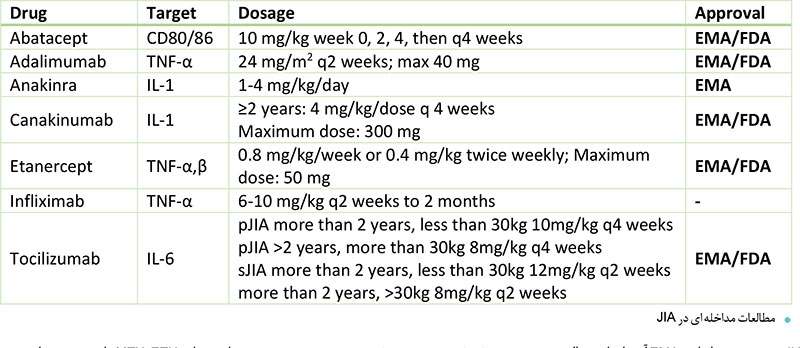
،ADA) adalimumab، (ETN) etanercept) golimumab و IFX) infliximab) و دارویــی که اخیرا ثبت شده است(Certolizumab pegol )(جدول2) مهارکننده های TNF را نشان میدهد که آژانس داروهای اروپایی (EMA )و ســازمان غذا و داروی (FDA )برای استفاده در JIA تأیید کرده است.
ETN اولین مهارکنندۀ TNF بــود که تقریبا دو دهه قبل تأیید شد. اثربخشی پایدار و مشخصات ایمنی خوب ETN در مطالعه ای چندمرحله ای CLIPPER تأیید شده است. در میان مهارکننده هــای TNF ،درمانی که در دورۀ پلی آرتیکولــر (JIA(pJIA اخیرا تأییــد شده اســت اســتفاده از golimumab است که
آنتی بادی ای مونوکلونال کامالا انســانی است وبا تزریق زیر جلدی اســتفاده میشود (آزمایش و با تزریــق داخل وریدی در حال انجام اســت).
golimumabباعــث بهبود درخــور توجهی در JIA میشــود؛ بنابراین EMA آن را برای معالجه کــودکان مبتلا به pJIA با وزن بیشــتر از چهل کیلوگرم تأیید کرده اســت. ســایر گزینه های مهارکننده های TNF برای درمان pJIA شــامل tocilizumab و abatacept است که هر دو برای استفاده در pJIA تأیید شــده اند. tocilizumab داروی مهارکنند ه 6-IL و anakinra and canak-inumab داروهای مهارکنندۀ 1-IL متداول ترین ماده بیولوژیک تجویزشــده در JIA سیستمیک هستند (sJIA)؛ درحالی که rilonacept به عنوان دارو برای نشانه JIA تأیید نشده است. معرفــی بیولوژیــک در درمــان sJIA باعــث افزایش چشــم گیر نســبت بیمــاران مبتلا به بیماری غیرفعال و کاهش بروز محدودیت های عملکردی به دلیل بیماری شــده است. یوکوتا و همکاران بیــش از چهارصد بیمــار مبتلا به sJIA را بررســی کردند که همگی تحت درمان با(TCZ (tocilizumab بودنــد و گزارش دادند که در مقایسه با مطالعات قبلی، عوارض جانبی
جدی تری، به ویژه عفونت ها، مشــاهده شــده است؛ اما مشــخصات کلی ایمنی پذیرفتنی تر بــوده اســت. در میــان 26 ابتلا به ســندرم فعال سازی ماکروفاژ (MAS ،)هیچ مرگ ومیری کــه حاکی از اهمیــت تشــخیص زود هنگام و درمان چنین عارضۀ شــدیدی باشــد رخ نداده است.
چشم انداز جدید درمان
در عصر پزشکی شخصی سازی شده با روشهای درمانی متناســب با ویژگیهای فردی بیمار با کمک نشــانگرهای زیســتی فردی یا چندگانه از بین بــردن التهاب مهم ترین هدف باقی مانده است که باید از طریق استراتژی مناسب، درمان (T2T) حاصل شود همان طور که اخیرا sus-based pediatric پیشنهادهایی داده است . علاوه بر این هنوز هم رویکردی گام به گام برای هدایت مدیریت JIA وجود دارد. به نظر میرسد رویکردی تهاجمی تر برای مداوای بیماران JIA ممکن است منجر به کنترل بهتر بیماری شود. به طور خــاص، در ســال 2014 ،نیگروویچ این احتمال داد جلوگیری از ترشح اولیه سیتوکین ممکن است پیشرفت بیماری را از بین ببرد که اغلب علت آن آرتریت مخرب و مقاوم به درمان اســت و منعکس کننده یــک «پنجره فرصت» در مراقبت از بیماران sJIA نیز اســت. ســال ها بعد، این موضوع، بوسیله ی مطالعاتی که امکان شروع درمان خط اول sJIA را توسط مونوتراپی کوتاه مــدت با rIL-1RAپررنــگ نمودند، تایید گردید؛ درمانی که باعث حفظ بیماری غیرفعال گشــته و از عوارض مرتبط با بیماری و عوارض مرتبط با گلوکوکورتیکوئید پیشگیری نماید. رویکرد تهاجمی تر را والاس و همکاران بررسی کرده اند. بــه برخی بیماران مبتــلا به pJIA که به طور تصادفی انتخاب شده بودند بدون اطلاعداروهــای ETN، MTX داده شــد؛ به این ترتیب که به سرعت اســتفاده از مونوتراپی پردنیزولون یا MTX بهصورت دوز افزایشــی شروع شد. پس از یک سال از شــروع درمان، بیماری غیرفعال بالینی (CID )در آنها ارزیابی شد. بیمارانی که در مراحل ابتدایی بیماری آســتروئید دریافتکرده بودند، راحت تر از ســایرین به CID دست پیــدا میکردند. این نشــان میدهــد درمان تهاجمی تر، همراه با مدت زمان بیماری کوتاه تر قبل از شروع درمان و پاســخ قوی در چهار ماه میتواند CID را مســاعد و طولانی کند. مطالعۀ یکســالۀ Tynjala و همکاران در فنالند بر روی بیماران مبتلا به pJIA ثابت کرد مصرف MTX با IFX برتر از MTX تنها اســت که با ترکیب MTX سولفاســالازین و هیدروکسی کلروکین برابری میکند. به تازگــی گروهی هلندی آزمایشــی دوســاله را با مقایســه سه اســتراتژی درمانی گزارش کرده اند:
- سولفاساالزین یا MTX به عنوان مونوتراپی مداوم
- MTX DMARDبا شش هفته پردنیزولون؛
- MTX و ETN.
از درمــان ترکیبی آنتیســیتوکین ها به دلیل عــوارض جانبی عفونــی شــدید در مطالعات بزرگســالان، تاکنون اجتناب شــده است. در حال حاضر هیــچ مطالعه ای در مــورد ترکیب زیستشناسی در کودکان موجود نیست.
دستاورد در عصر داروهای بیولوژیک ضد روماتید تعدیل کنندۀ بیماری
ظهور روش هــای درمانــی بیولوژیــک نتایج جســمی و عملکردی بیماران مبتلا به بیماری روماتیسمی را بســیار بهبود بخشیده است؛ اما این روش، به ویژه در کشورهای با کمبود منابع امکانپذیر نیســت. درواقع شیوع فنوتیپ های بیماری و اختــلاف در انتخاب ها و نتایج درمانی در مناطــق جغرافیایی مختلف و وضعیت ثروت کشــورها تنوع زیادی دارد، همانطور که اخیرا با مطالعۀ EPOCA نشــان داده شــده اســت( اپیدمیولوژی، درمــان و نتیجۀ آرتریت دوران کودکی در سراسر جهان).
نویسندگان مروری کلی درباره شیوع دسته های ILAR ،گزینه های درمانی و وضعیت ســلامتی 9081 بیمار JIA از 49 کشــور در پنج قاره ارائه داده اند؛ با شواهدی به شرح زیر:
آرتریــت سیســتمیک: 125 از 379 بیمــار(33درصــد)و آرتریت مرتبط بــا آن: 113 از379( 8/29درصد)در جنوب شــرقی آســیا؛ oligoarthritis در جنوب اروپا: 1360 از 2400 (7/56درصد)؛ پلــی آرتریت بــا فاکتور منفی روماتوئیــد در آمریکای شــمالی: 165 از 523(5/۳۱درصد).
شــیوع یووئیت در شــمال اروپا و جنوب اروپا بیشترین مقدار را داشــت، به ترتیب: 16۱ نفر از 845 بیمار (1/19درصد) و 450 نفر از 2400 بیمــار (8/18درصــد)؛ کمتریــن در آمریکای لاتیــن: 54 نفــر از 849 بیمــار (4/6درصد)؛ آفریقــا و خاورمیانــه: 71 نفــر از 1209 بیمار (9/5درصد)؛ جنوب شرقی آسیا: 19 نفر از 379
بیمار (۵درصد).
مهمترین اختلاف در نسخه های بیولوژیک بود که در شمال اروپا و آمریکای شمالی بیشتر بود و احتمالا مسئول آســی بهای ناشی از بیماری اســت که لزوم دســتیابی بهتر بــه درمانهای مؤثرتر را در کشورهای فقیر برجسته میکند.
تازه هایی از تجربۀ بزرگسالان
تجربۀ بزرگسالان در آرتریت روماتوئید (RA ) راه را برای اســتفاده از اهــداف جدید مولکولی ممکن کرده و توســعۀ داروهای در دسترس را فراتر از داروهای تأییدشده برای کودکان مبتلا به JIA باز کرده است (جدول 2). از سال 2012 مهارکننده های Janus kinas) JAK) اثربخشی خــود را در چندین شــکل از آرتریــت التهابی بزرگسالان نشان داده اند، مانند RA و آرتریت پســوریاتیک (PSA ،)با این مزیت که به عنوان
درمانهای خوراکی ارائه میشوند. JAK نمایندۀ خانوادۀ داخل سلولی غیرگیرنده از تیروزین کیناز است که از طریق مسیر STAT-JAK ســیگنال های با واســطه ســیتوکین را منتقل میکنــد. Tofacitinib مولکولی کوچک اســت که JAK3 و JAK1 و به میزان کم JAK2 آن به نوبه خود چندین ســایتوکاین را که ازنظر
عملکرد لنفوســیت ها مهم هســتند مســدود میکند. مصرف Tofacitinib خوراکی نشان داده است که در درمان RA مؤثر است.
آزمایشها با tofacitinib با هر دو شــکل قرص و شــربت در pJIA و sJIA در کودکان آغاز شده است. ازجمله سـایر مهارکننده های کینازBA-ricitinib اســت که ضد JAK2 / JAK1 اســت و به صــورت خوراکی مصرف میشــود. به تازگی ایمنــی و اثربخشــی baricitinib در بیمــاران سالخورده (سن بیشتر از 65 سالگی ) با بیماران کمتر از پنجاه سال و حداقل پنجاه و کمتر از 65 ســال، با داده های جمع آوری شده از بیماران دو مطالعه با پاسخ ناکافی به DMARDs قراردادی مقایسه شــد. نویســندگان اثربخشی مشابهی از baricitinib در بیماران مســن و جوان و بروز SAEs یا خروج به علت عوارض جانبی مشــابه با پالســبو را نشــان دادند. تبخال زوستر در بیماران تحت درمان با baricitinib بیشــتر بود و در 24 هفتــه، چهار بیمار درگذشــتند . (همه بیماران بیش از پنجاه سال داشتند). با توجه به اثرات مهارکننده های JAK در ســیگنالینگ -IL6 ،ناهنجاری های پروفایل لیپیدی مشابه زمانی است که با آنتاگونیست گیرنده 6-IL مانند TCZ مشــاهده میشــود. در بیماران RA در مقایسه با گروه کنترل ســالم، عوارض قلبی و عروقی و مرگ ومیــر افزایش یافته اســت. آزمایشهای
بالینــی و داده هــای گســتردۀ طولانی مدت افزایش خطر ابتــلا به بیماریهای قلبی عروقی با هیچیــک از مهارکننده های JAK را نشــاننداده است. ســایر مهارکننده های 6-ILکه علیه سیتوکین، نه در برابر گیرندۀ محلول آن، توسعه یافته انــد شــامل sirukumab، sarilumab و clazakizumab است. هدف قراردادن 17-IL در PSA و اســپوندیلیت آنکیلوزان مفید است. Ustekinumab آنتیبادی مونوکلونال است که12-IL و 23-IL را هدف قرار داده اســت در بزرگســالان علائم و نشانه های PSA ،ازجمله ضایعات پوستی را به مقدار زیاد کاهش میدهد. در حــال حاضر هیچ مطالعه ای در کودکان موجــود نیســت. Secukinumab آنتی بادی مونوکلونال ضد اینترلوکین17A است که به طور چشمگیری مؤثرتر از دارونما در درمان هر دو بیماری PSA و اسپوندیلوزیس آنکیلوزان
است. مطالعات در RA نشان داده است که درمان سه گانه(MTX ،سولفاســاالزین و هیدروکسیکلروکین) نسبت به درمان با MTX در بیمارانی
که علی رغــم MTX درمانی، دارای بیماری فعال بودنــد، تفاوتــی نمیکند. مطالعاتــی در مورد secukinumab در کودکان مبتلا به 9 و آرتریت مربوط به التهــاب بافتی که رباط و عضلات را به هم متصل میکند و مطالعه ای در مورد ab-sarilum درJIA سیستمیک در حال انجام است.