کرونا ویروس با سندرم حاد تنفسی شدید ۲ (SARS-COV2) : یک عفونت سیستمیک
تاکنون هفت کرونا ویروس CoVs تایید شده برای بیمار کردن انسانها شناخته شدهاند. از این دسته سه واریانت بسیار پاتوژنیک در قرن ۲۱ پدیدار شدهاند. جدیدترین عضو این گروه کرونا ویروس، با سندرم حاد تنفسی شدید ۲ (SARS-COV2) نخستینبار در انتهای سال ۲۰۱۹ در استان هوبای چین، شناسایی شد. از آن زمان، این کرونا ویروس جدید در جهان انتشار پیدا کرده و پاندمی ایجاد کرده است. بیماری تنفسی که توسط این ویروس ایجاد میشود؛ بیماری کرونا ویروس ۲۰۱۹ (کووید۱۹) نامیده میشود. علائم بالینی از بدون علامت تا عفونت خفیف دستگاه تنفسی و بیماری مشابه آنفولانزا، تا بیماری شدید به همراه آسیب ریوی، نارسایی چندین ارگان و مرگ متفاوت است. با اینکه تصور میشود ریهها محل تکثیر SARS-COV2 هستند، افراد مبتلا اغلب علائم دیگری گزارش میکنند؛ که مطرح کننده درگیری دستگاه گوارش، قلب، سیستم قلبیعروقی، کلیهها، و سایر ارگانها هستند. بنابراین سوال پیشرو ایجاد میشود: بیماری کووید۱۹ یک بیماری تنفسی است؛ یا یک بیماری سیستمیک؟ هدف این مقاله مروری بررسی دادهها درباره تکثیر SARS-COV2 در بافتهای مختلف، در هردو گروه بیماران و مدلهای ex vivo است.
مقدمه:
کروناویروسها CoVs، ویروسهای تکرشتهای مثبت، غیرقطعهای پوششداری هستند که به خانواده کروناویریده تعلق دارند؛ و میتوانند هم انسانها و هم حیوانات را مبتلا کنند. تا به امروز هفت CoVs با توانایی ابتلای انسانها گزارش شدهاند؛ که چهارتا از آنها با اسامی: human CoV-NL63 (HCoV-NL63)، HCoV-OC43، HCoV-229Eو HCoV-HKU1 در جهان انتقال پیدا کرده و منجر به بیماریهای خفیف فصلی دستگاه تنفسی شدهاند. نکته حائز اهمیت این است که، سه تا از هفت CoVs در قرن ۲۱ پدید آمدهاند و منجر به عفونتهای حاد و شدید دستگاه تنفسی میشوند. CoV با سندروم حاد و شدید دستگاه تنفس SARS-CoV اواخر سال ۲۰۰۲ در استان گواندونگ چین ایجاد شد؛ و به سرعت در سایر کشورها و قارهها پخش شد و منجر به ابتلای ۸۰۰۰ مورد قطعی و نرخ مرگ و میر ۹.۶٪ شد. SARS-CoV یک بتاکروناویروس است که از خفاشهای نعل اسبی نشأت گرفتهاند، و متعاقب آن به جمعیت حیوانات وحشی چین از جمله palm civetها راه یافتند. ویروس تغییراتی پیدا کرد و در نهایت از طریق ارتباط مستقیم انسان-حیوان، به انسانها منتقل شد. با اینکه انتقال انسان به انسان این ویروس کارآمد بود، اپیدمی به علت ماهیت فصلی ویروس و اعمال مراقبتهای بهداشتی در ماه می سال ۲۰۰۴ به اتمام رسید. از آن زمان هیچ مورد ابتلایی به SARS-CoV گزارش نشده است. CoV با سندرم تنفسی خاورمیانه، (MERS-CoV) ۱۰سال بعد پدید آمد و باعث طغیان در عربستان سعودی و کرهجنوبی شد. همانند SARS-CoV ، MERS-CoV نیز از خفاشها نشأت گرفت، اما میزبان واسط آن شترهای یک کوهانه بودند. هنوز مشخص نیست که ویروس چطور بین این حیوانات منتقل شده است؛ و یکی از فرضیات وجود میزبان حدواسط دیگری است. درحالی که انتقال انسان به انسان MERS-CoV منجر به بیماری نیمی از مبتلایان شد، محدود به افراد خانواده یا انتقال بیمارستانی بود و برای انتقال، تماس نزدیک و طولانیمدت مورد نیاز بود. با این وجود، MERS-CoV مسئول ۲۴۰۰ ابتلا، طی ۸ سال گذشته با نرخ مرگ و میر متغیر ۳۴٪ بود. ایندو کروناویروس بسیار بیماریزا، توجه محققان را به خود جلب کردند و منجر به تحقیقات متعدد، درباره پتانسیل کروناویروسهای زئونوتیک برای ایجاد پاندمی در انسانها شدند. کشف تعداد زیادی از کروناویروسهای مشابه SARS، در خفاشهای یونان چین منجر به این استدلال شد که ممکن است دوباره با ویروس SARS مواجه شویم. درواقع، سال ۲۰۱۹ یکی از کروناویروسهای زئونوتیک جدید را برای ما به ارمغان آورد، که بهنظر میرسد قرابت نزدیکی با 2002 SARS-CoV دارد. CoV2 با سندروم حاد و شدید دستگاه تنفسی (SARA-CoV2) در استان هوبای چین پدید آمد. این ویروس که در ابتدا 2019-nCoV نامیده شد، متعلق به دسته ویروسهای شبه SARS است؛ و با اولین SARS-CoV کشف شده در سطح نوکلئوتیدی ۸۶٪ هومولوژی دارد. بیماریای که با این ویروس ایجاد میشود، بیماری کروناویروس ۲۰۱۹ (کووید۱۹) نامیده شد. علائم بالینی از بدون علامت تا عفونت خفیف دستگاه تنفسی و بیماری مشابه آنفولانزا (غالبا تب، سرفه و خستگی) تا بیماری شدید به همراه آسیب ریوی، نارسایی چندین ارگان و مرگ متفاوت است. مشخص است که ریهها محل اصلی ورود عفونت هستند، بااینحال RNA ویروس SARS-CoV-2 در کلیهها، کبد، قلب، مغز و نمونههای خون حاصل از اتوپسی پیدا شدهاند. این یافتهها با گزارشاتی که حاکی از سایر علائم موجود در اغلب بیماران مبتلا به کووید۱۹، همخوانی دارد و مطرحکننده درگیری چندین ارگان و عوارض نادر اما شدید تکثیر SARS-CoV-2 است که سندروم التهاب مولتیسیستم (MIS) در کودکان (MIS-C) و در بزرگسالان (MIS-A) است. هدف این مقاله مروری، بررسی و گردآوری دادههای موجود، در ارتباط با تکثیر SARS-CoV-2 در بافتهای مختلف است.
دستگاه گوارش
اگرچه عفونتهای کرونا ویروس در انسان، عمدتاً با بیماری مجاری تنفسی همراه است، اما علائم همراه آن در دستگاه گوارش (GI) نیز گزارش شده است. براساس یک مطالعه، در طی شیوع SARS-CoV در مارس 2003 در هنگ کنگ، 19.6٪ از بیماران مبتلا دچار حالت تهوع، اسهال و یا استفراغ شدند. مطالعه دیگری گزارش داد که 38٪ بیماران در طول بیماری، خود اسهال را تجربه کردهاند. نکته جالب توجه این است که بعضی از بیماران (5.8٪) با تب و اسهال به بیماری تنفسی مبتلا نشدهاند. درنتیجه، تکثیر ویروسی در روده کوچک و بزرگ بیماران مبتلا به SARS-CoV تأیید میشود. عفونت توسط کروناویروس بسیار بیماریزا یعنی، MERS-CoV نیز با علائم GI همراه بود. مطالعات توصیفی، از سال 2012 تا 2013 گزارش دادهاند که یک چهارم بیماران MERS مثبت دارای علائم GI همراه، از جمله اسهال و استفراغ بودند. نکته مهم این است که، نه تنها کرونا ویروسهای پاتوژن شدید، بلکه ویروسهای فصلی انسانی نیز با عفونتهای دستگاه گوارش در ارتباط هستند. به عنوان مثال، 33٪ از بیماران HCoV-NL63 مثبت و 57٪ بیماران HCoV-OC43 مثبت در فرانسه دچار مشکلات گوارشی مانند: دل درد، اسهال و استفراغ شدند. این دادهها به وضوح نشان میدهد که مسیر فکال-اورال انتقال ویروس کرونا دارای نکات پژوهشی مهمی است؛ که در طی شیوع COVID-19 نیاز به بررسی بیشتر دارد.
پساز ظهور SARS-CoV-2 ، مشاهده شد که بیماران COVID-19 اغلب از علائم بیماری دستگاه گوارش رنج میبرند؛ و تا 53٪ بیماران آلوده به SARS-CoV-2 از نظر RNA ویروسی در نمونههای مدفوع مثبت هستند. علاوه بر این، RNA ویروسی تا 5 هفته پس از منفی شدن نمونههای تنفسی، میتواند در نمونههای مدفوع تشخیص داده شود. در مقابل، در بعضی از بیماران، بروز علائم دستگاه گوارش با تشخیص RNA ویروسی در نمونههای مدفوع ارتباط ندارد. برخی تصور میکنند که این علائم ممکن است مربوط به تغییر در میکروبیوتای روده و یا به هم خوردن بالانس زیستی، (dysbiosis) طی COVID-19 باشد. این یافتهها تکثیر SARS-CoV-2 در دستگاه GI را قطعی نمیکند. رنگآمیزی ایمونولوژیک پروتئینهای ویروسی، در نمونههای بافت گوارشی جمع آوری شده از بیماران مبتلا، شواهدی از تکثیر ویروس در این بافتها را فراهم میکند، که مسیر فوکال-اورال را تنها بهعنوان یک مسیرانتقال نسبی مطرح میکند. علاوه بر این، برخی از گروهها جداسازی موفقیتآمیز ویروس عفونی را از نمونه مدفوع گزارش کردهاند.
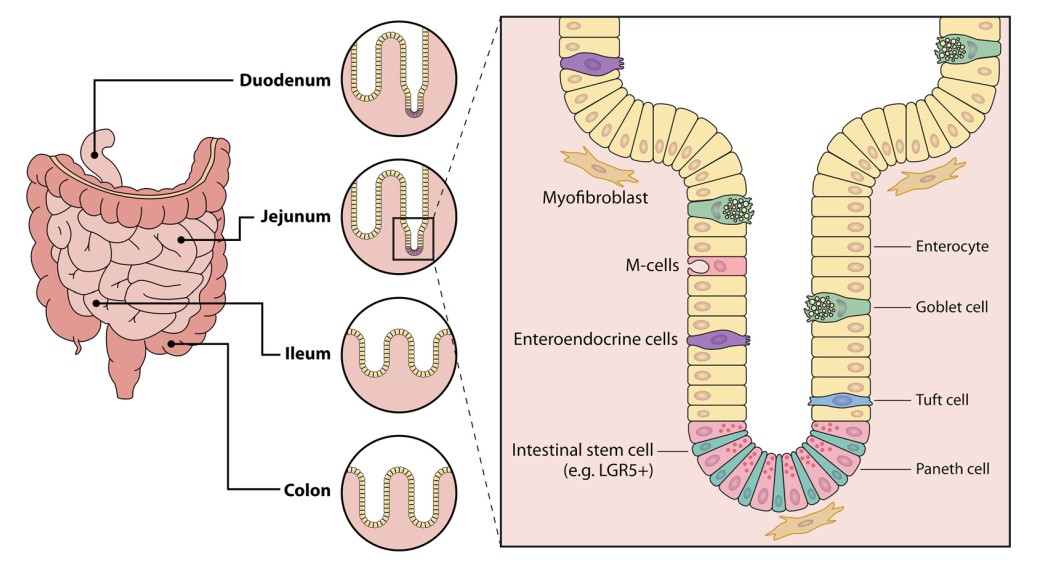
تلاش برای مدلسازی عفونت GI در شرایط in vitro منجر به تعریف چهار رده سلولی سرطان روده بزرگ (سلولهای اپیتلیال روده انسان (IECs)) که قادر به عفونت SARS-CoV-2 هستند، شد: Caco-2 (همچنین مستعد عفونت با SARS-CoV هستند) – C2BBe1))، Caco-2 زیررده بیان کننده حاشیه برسی (brush border)؛ CL14؛ و T84. با این حال، اکثر مدلهای niche-mimicking و مدلهای دستگاه GI بر اساس استفاده از ارگانوئیدهای روده انسان (HIO) هستند، و در حال حاضر پیشرفتهترین ابزار موجود هستند. HIOها ازنظر تمایز، تغییر شکل نیافتهاند و محیطهایی از نظر فیزیولوژیکی فعال هستند؛ و حاوی چندین نوع سلول اپیتلیال روده مانند: سلولهای انتروسیت، سلولهای جامی، سلولهای tuft، سلولهای انترو اندوکرین (EECs) و سلولهای پانت هستند. انواع سلولهای موجود در رودهها، در شکل 4 نشان داده شده است. نکته مهم این است که، یک مطالعه اخیرا نشان داد که HIOها قادر به تکثیر MERS-CoV، همراه با ویروسهای دیگری است که با استفاده از سلولهای استاندارد قابل کشت نیستند. HIOها، که میتوانند در تکلایههای سه بعدی (3 بعدی) یا 2 بعدی رشد کنن، از تکثیر SARS-CoV-2 و SARS-CoV در اندامکهای ایلئوم ، اثنی عشر و روده بزرگ پشتیبانی میکنند. مهمتراز همه، رودهها تنها قسمت تحت تأثیر دستگاه گوارش نیستند. پروتئین نوکلئوکپسید ویروسی در بافت معده، حاصل از بیماران COVID-19 مشاهده شد. جای تعجب نیست که ارگانوئیدهای معده انسانی، (HGO) که از کودکان بیمار بهدست آمده از تکثیر SARS-CoV-2 پشتیبانی میکنند. توجه داشته باشید، ارگانوئیدهای انسانی تنها ارگانوئیدهای مجاز برای ویروس کرونا نیستند. ارگانوئیدهای روده خفاش نیز از عفونت SARS-CoV-2 پشتیبانی میکنند، که با پیشبینیهای خواستگاه ویروس سازگار است.
به طور کلی، ACE2 گیرنده ورودی ویروس است و TMPRSS2 پروتئاز، آغازگر آبشار است. به شکل جالب توجهی، میزان بیان ACE2 در بافت روده، بسیار بالاتر از آن است که در ریهها دیده میشود. به عبارت دقیقتر، ACE2 به وفور در سلولهای اپیتلیال معده و در سلولهای روده کوچک از جمله دئودنوم، ژژنوم و ایلئوم بیان میشود؛ و در کولونوسیتها ضعیف بیان میشود. جای تعجب نیست که کلونوئیدهای انسانی، کمتراز ارگانوئیدهای حاصل از روده کوچک تحت تأثیر قرار میگیرند. درنتیجه، SARS-CoV و SARS-CoV-2 فقط سلولهای انتروسیت را آلوده میکنند؛ و بر سلولهای گابلت، EECها، سلولهای tuft یا سلولهای Paneth بیتاثیرند. انتروسیتهای بالغ سطح ACE2 بالاتری نسبت به سلولهای نابالغ بیان میکنند، اما میزان تکثیر قابل مقایسه است. این ممکن است نشان دهد که سطح پایین بیان ACE2 برای ورود ویروس به سلول کافی است یا یک عامل محدودیت دیگر در سلولهای انتروسیت بالغ وجود دارد. آنچه جالب است این است که، بیان ACE2 در طی پیشرفت سرطان معده و روده بزرگ افزایش مییابد. همچنین افزایش بیان ACE2، در بیماران مبتلا به بیماری التهابی روده (IBD) مشاهده میشود. اگرچه ACE2 تنها فاکتور لازم برای ایجاد عفونت نیست، ممکن است تصور شود که بیماران سرطانی یا بیماران مبتلا به IBD علائم گوارشی شدیدتری را تجربه خواهند کرد. با این وجود، این حوزه تحقیقاتی به مطالعات بیشتری نیاز دارد. مدلهای تکلایه رودهای انسان نشان دادهاند که SARS-CoV-2 به طور موثری در انتروسیتها، تکثیر شده ایجاد عفونت میکند و از سمت آپیکال آزاد میشود. به جز ACE2 ، “بازیکنان” دیگری در هنگام ورود ویروس وجود دارند، در رودهها، پروتئین Spike، مانند سایر اندامها ، توسط TMPRSS2 و احتمالاً توسط TMPRSS4 (123) تحریک میشود. همانند دستگاه تنفسی، به نظر میرسد نقش کاتپسین در فعالیت in vivo و ex vivo محدود است.
با این وجود، میتوان تصور کرد که التهاب روده میتواند منجر به سندرم “leaky gut” شود. این سندرم میتواند منجر به توزیع سیستمیک ویروس و عفونت اعضای دیگر، مانند، ریهها یا قلب شود. هیچ گزارشی نشان نداده است که ویروس عفونی در خون یافت میشود، اما RNA ویروسی در 15٪ نمونههای پلاسما از بیماران COVID-19 در یک مطالعه مشاهده شد. بعلاوه، توزیع سیستمیک ویروس تایید میکند که SARS-CoV-2 ممکن است توسط خون یا سلولهای خونی منتشر شود. مطالعه مشابهی برای MERS-CoV انجام شد که موشهای داراری دی پپتیدیل پپتیداز 4 (DPP4) انسانی از طریق گوارشی به ویروس آلوده شدند، علاوه بر بیماری GI، حیوانات به عفونتهای ریه و مغز نیز مبتلا شدند. اگر وضعیت در بیماران COVID-19 مشابه باشد، نتایج میتواند گزارشهای بالینی که نشان میدهد بیماری دستگاه گوارش قبل از علائم دستگاه تنفسی است را تایید کند، درحالی که progeny ویروسی عفونی توسط ارگانوئیدهای روده تولید میشوند و SARS-CoV-2 عفونی را میتوان از نمونههای مدفوع جدا کرد، اهمیت مسیر انتقال فوکال-اورال برای SARS-CoV-2 همچنان نامشخص است. اگرچه به نظر میرسد دستگاه GI محلی برای تکثیر باشد، لازم به ذکر است که برای استفاده از این مسیر، ویروس باید از دستگاه GI عبور کرده و همچنان عفونی باشد. این جای سوال دارد، زیرا قبلاً نشان داده شده بود که ویروس نوترکیب گزارشگر SARS-CoV-2 mNeonGreen به غیرفعال شدن با مایعات معده انسان حساس است. یک پدیده مشابه برای MERS-CoV گزارش شده است، که به نظر میرسد ویروس مایعات معده و روده تولید شده در هنگام تغذیه را تحمل میکند؛ اما مایعات زمان گرسنگی را تحمل نمیکند. با استفاده از دادهها به طور کلی، هنوز مشخص نیست که آیا دستگاه گوارش میتواند محل اصلی عفونت باشد. تحقیقات بیشتر و توسعه مدلهای حیوانی مناسب، موردنیاز است.
سیستم قلبی عروقی
سیستم قلبیعروقی نیز بهعنوان هدفی برای عفونت SARS-CoV-2 شناخته شده است. عوارض قلبیعروقی برای سایر کروناویروسهای انسانی، بسیار بیماریزا گزارش شدهاند. در بیماران SARS-CoV این عوارض معمولا خفیف و خود محدود شونده هستند، اما در MERS-CoV با میوکاردیت حاد و نارسایی قلبی مرتبط بود. بهخوبی میدانیم که بیماران مبتلا به بیماریهای قلبیعروقی، بیشتر مستعد عوارض COVID-19 هستند و به بستری شدن در آیسییو نیاز دارند. بنابراین آسیبهای میوکاردیال و نارسایی قلبی، به عنوان عارضه COVID-19 در نظر گرفته میشود. با این وجود ممکن است مطرح شود که، تظاهرات بالینی قلبیعروقی ممکن است تنها در اثر ترومبوز باشد.
حوادث عروقی
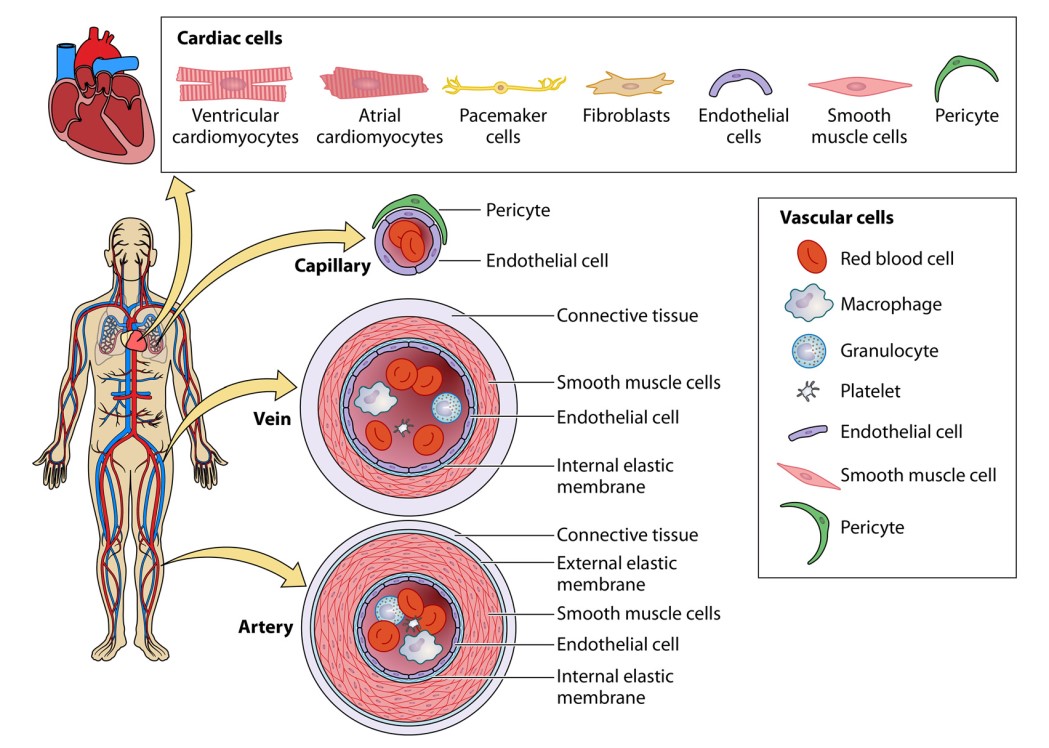
سلولهای اندوتلیال، گروهی از جمعیت سلولی ریهها و همچنین عضو سیستم قلبیعروقی هستند. بسیار مهم هست که این سلولها گیرندههای ACE2 و همچنین سایر مولکولهایی که ممکن است حدواسط عفونت باشند، را بیان میکنند. وجود ویریونهای SARS-CoV-2 درون سلولهای اندوتلیال تایید شده است. علاوه بر آن اندو تلیت و افزایش سطح سلولهای اندوتلیال در گردش خون، مشاهده شده است. انواع سلولهایی که در سیستم گردش خون وجود دارند، در شکل ۵ نشان داده شدهاند. عفونت منجربه تولید ویروسهای progeny ویرولنت میشود؛ که بااستفاده از ارگانوئیدهای مویرگی انسانی تایید شده است.
بسیار جالب است که، بیماری شدید در کودکان نادر است. با این حال، موارد متعدد بیماری کاوازاکی، ابتدا در استان برگامو ایتالیا و در انگلستان و پساز آن در مناطق دیگر، گزارش شدهاند. بیماری کاوازاکی، یک واسکولیت حاد کودکان با منشاء نامشخص است؛ و با انوریسمهای شریان کرونر مرتبط است. اعتقاد براین است که پاسخ نابجای سیستم ایمنی است؛ و پیشاز این تصور براین بود که کرونا ویروسهای انسانی محرک آن هستند. کودکانی که این بیماری در آنها تشخیص داده شده؛ عموماً از سن معمول سندروم کاوازاکی بزرگتر هستند و با بیماری شدیدتری تظاهر میکنند. برخی از آنها به حمایتهای تنفسی و عروقی نیاز دارند، و انوریسمهای شریان کرونر عارضه شایعی در آنها است. بر اساس این موارد، تعریف بیماری MIS-C، که همچنین سندروم التهابی مولتی سیستم کودکان PMIS یا PIMS نامیده میشود، بهدست آمد. علائم مشابهی بعداً در نوجوانان و بزرگسالان مشاهده شد؛ که منجر به تشخیص سندروم التهاب چند سیستمی در بزرگسالان MIS-A شد. برخلاف سایر موارد شدید کووید ۱۹ بیمارانی که MIS-C یا MIS-A داشتند، علائم تنفسی کمتری داشته و اغلب تست PCR در آنها برای SARS-CoV-2 منفی بود، که مطرح کننده این است که این مجموعه علائم عوارض پاتولوژیک عفونت هستند.
اعتقاد بر این است که سیستم رنین آنژیوتانسین، RAS، نقش اصلی را در پاتوژنز کووید ۱۹ بازی میکند؛ و داروهایی که مسیر RAS را تنظیم میکنند به عنوان درمانهای بالقوه پیشنهاد شدهاند. در شرایط فیزیولوژیک کاهش جریان خون کلیه، ترشح رنین را تحریک میکند و باعث تشکیل آنژیوتانسین 1 میشود. سپس آنزیم تبدیل کننده آنژیوتانسین (ACE)، آنژیوتانسین ۱ را به آنژیوتانسین ۲ تبدیل میکند، که اثراتی مانند: وازوکانستریکشن، احتباس آب و نمک در کلیه، فیبروز، التهاب و افزایش نفوذ پذیری عروق دارد. همچنین این آنزیم با فعال کردن آبشار انعقادی، باعث افزایش ترومبوز و هجوم نوتروفیلها و ماکروفاژها به بافتهای مبتلا میشود. متقابلا ACE2 آنژیوتانسین را به قطعاتی تبدیل میکند (Ang1 تا Ang9 و Ang1 تا Ang7) که خواص وازودیلاتوری، ضدالتهابی، ضدتکثیر، ضدفیبروز و محافظت قلبی دارد. عفونت SARS-CoV-2، ازبین رفتن اثرات کاتالیتیک ACE2 را تسهیل میکند؛ و بیان آن را تنظیم کاهشی (downregulate) میکند. درحالیکه مهارکنندههای ACE (ACEIs)یا بلاک کنندههای گیرنده آنها (ARBs) میتوانند مفید باشند، توصیه به استفاده از آنها مورد بحث است.
به علاوه، کواگولوپاتی و حوادث ترومبوآمبولی حاصل از آن، در بیماران کووید ۱۹ مشاهده شده است. این نکته حائز اهمیت است که این بیماریها بهعنوان علت مرگ، در یک سوم موارد بیماری تشخیص داده شدهاند. درنتیجه انجمن بینالمللی ترومبوز و هموستاز، دوزهای پروفیلاکتیک هپارین با وزن مولکولی پایین LMWH را برای بیمارانی که به بستری شدن در بیمارستان نیاز دارند، توصیه میکند، که به طور معناداری مرگ و میر را کاهش میدهند. جالب است که این نتیجه، نه تنها در اثر فعالیت ضد انعقادی LMWH میباشد، بلکه در اثر فعالیت ضد التهابی و مهار وابسته به LMWH اتصال ویروس به سلولها میباشد. مکانیسم زمینهای دقیق کواگولوپاتی ناشناخته است با این حال گزارشات اخیر، نقش بههم خوردن تنظیمات محور RAS، التهاب و فعالیت کمپلمانها، تشکیل شبکههای خارج سلولی نوتروفیل (NETs)، سکون طولانی مدت بیماران و فعال شدن سلولهای اندوتلیال و پلاکتها را مطرح میکند. سلولهای اندوتلیال در دو سمت خود با خون و گلیکوکالیکس اندوتلیال در ارتباطند، که ویژگیهای ضدانعقادی و ممانعت از فعالیت و تجمع پلاکتها را ایجاد میکند. تخریب اندوتلیال میتواند به راحتی این شرایط را ایجاد کند؛ و منجر به ایجاد انعقادهای داخل عروقی وسیع شود به علاوه، درحالیکه تشکیل NET بخشیاز فعالیت دفاعی درمقابل پاتوژنها هستند، بههم خوردن تنظیم این فرایند طی بیماری کووید ۱۹ میتواند منجر به تخریب اندوتلیال و انسداد عروق خونی شود. درنتیجه SARS-CoV-2 میتواند در هایپرکواگولاسیون دیده شده در بیماران، و نارسایی مولتی ارگان در موارد شدید بیماری دخیل باشد. درمیان سایر تظاهرات SARS-CoV-2، ضایعات پوستی مشابه سرمازدگی که باعنوان انگشتان کووید شناخته شدهاند، نیز با تخریب اندوتلیال مرتبطند. درحالیکه براساس دادههای PCR شواهد عفونت با قطعیت دیده نشدهاند، ذرات و پروتئینهای ویروسی، پیشاز آن در سلولهای اندوتلیال نمونههای پوستی مشاهده شدهاند.
قلب
فرضیههای متعددی درباره مکانیسم اصلی آسیب قلبی در بیماری کووید ۱۹ وجود دارد. این فرضیهها شامل آسیب مستقیم به واسطه تهاجم ویروسی SARS-CoV-2، عفونت ریوی، موارد شدید القا شده با هایپوکسی که منجربه آسیب به سلولهای میوکارد میشود، کاردیوتوکسیسیتی داروهای ضدویروسی و آسیب مستقیم به واسطه پاسخهای ایمنی بیشاز اندازه میباشد. این آسیبهای غیرمستقیم مخصوصاً در مبتلایانی که بیماریهای زمینهای دارند، و التهاب میتواند با پاره شدن پلاکهای آترواسکلروتیک کرونر مرتبط باشد دیده میشوند. علاوه بر این، تخریب سلولهای اندوتلیال و فقدان محافظت قلبی ایجاد شده توسط Ang1 تا Ang7 نیز میتواند منجربه آسیب میوکارد شود. گزارشات متعددی افزایش سطح تروپونین سرم، کراتینین کیناز، لاکتات دهیدروژناز را در افراد مبتلا به کووید ۱۹ ثبت کردهاند. غلظت بالاتر تروپونینها که منعکس کننده آسیب قلبی است، در ۵ تا 27.8 درصد از بیماران بستری در بیمارستان دیده شده است و به طور معناداری با پروگنوز بدتر، و افزایش خطر مرگ و میر مرتبط است. بیان بالای ACE2 در قلب مطرح کننده این است که آسیب مستقیم محتمل است. در واقع پریسیتها، باتوجه به بیان بالای ACE2، بهعنوان سلولهای قلبی هدف برای SARS-CoV-2، تصور میشوند. ذرات ویروسی در کاردیومیوسیتهای بهدست آمده از سلولهای القا شده پلوریپوتنت بنیادی انسان نشان داده شدهاند که، منجربه اثرات سیتوپاتی واضح و کاهش قدرت انقباض شدهاند.
سیستم ایمنی
درحال حاضر ، اطلاعات زیادی در مورد تأثیرات SARS-CoV-2 بر روی سیستم ایمنی در دسترس نیست. لوزههای پالاتین از اولین خطوط دفاعی هستند؛ و گزارش شده است که SARS-CoV-2 ارگانوئیدهای لوزه سه بعدی، که نشاندهنده اپیتلیوم لوزه in vivo است، را آلوده کرده و در آنها تکثیر میشود. علاوه بر این، سایر ارگانهای مسئول پاسخهای ایمنی، مورد بررسی قرار گرفتند و همچنین تخریب سلولی یا نکروز در طحال مشاهده شد. همچنین، Diao و همکاران نشان دادند که لنفوسیتوپنی در بیماران COVID-19 شایع بوده و این یافته در مطالعات دیگر نیز تأیید شده است. درنتیجه احتمال آلوده شدن اجزای سیستم ایمنی بدن توسط SARS-CoV-2 و پروگنوز بد، در صورت ازدست دادن زیرمجموعههای خاصی از سلولهای T، مطرح شده است. همچنین اثبات شده است که این ویروس، ماکروفاژهای آلوئولار و همچنین ماکروفاژهای ACE2 مثبت و CD68 مثبت را آلوده و ترشح اینترلوکین -6 (IL-6) را القا میکند، که در برخی موارد با نتایج کشنده همراه بوده است. اثرات مشابهی توسط SARS-CoV و MERS-CoV مشاهده شده است، و درحالیکه اکثر آزمایشگاهها تکثیر ضعیف، ناقص یا بینتیجه را گزارش میکنند، به نظر میرسد این ویروسها باعث ترشح سیتوکینهای پیشالتهابی از ماکروفاژها و سلولهای دندریتیک شده که منجربه التهاب شدید سیستمیک (“طوفان سیتوکین”) میشود. البته SARSCoV-2 غالبا در سلولهای مونوسیت و B و بهمیزان کمتری در سلولهای T بیماران COVID-19 تشخیص داده شده است. میزان مجاز این سلولها با استفاده از سلولهای تکهستهای خون محیطی (PBMC) از اهدا کنندگان سالم، پیشتر تأیید شده است. باتوجه به سطح پایین بیان ACE2 ، میزان مجاز (permissiveness) لنفوسیتهای T نیازبه توجه دارد. با این حال، برای تأیید این پدیده، نیازبه مطالعه بیشتر بوده و همچنان قابل بحث است. این نتایج، مشابه نتایج گزارش شده برای MERS-CoV است، که سلولهای T را آلوده کرده و باعث آپوپتوز آنها میشود. به طور شگفتآوری، سلولهای T دربرابر عفونت توسط SARS-CoV مقاوم هستند. ورود SARS-CoV-2 به لنفوسیتها غیرمنتظره است؛ زیرا عفونت MERS-CoV با میزان DPP4 سطحی ارتباط دارد. با این حال، ACE2 در سلولهای T تقریباً وجود ندارد. مسیر ورودی جایگزین میتواند مسیرمرتبط با گیرنده CD147 باشد، زیرا این مولکول بهطور گستردهای توسط لنفوسیتهای T یا DPP4 بیان میشود؛ و تعامل بین دامنه Spike S1 و DPP4 پیشبینی شده است. با این حال ، این دادهها به صورت تجربی تأیید نشده و باید بااحتیاط تفسیر شوند. درحالیکه سیستم کمپلمان، اولین پاسخ سیستمایمنی بدن به عفونت را نشان میدهد، شواهد زیادی وجود دارد که نشان میدهد فعال شدن این سیستم توسط ویروس در پاتوژنز COVID-19 نقش دارد. هنوز ناشناختههای بسیاری وجود دارد، اما آنالیزهای پساز مرگ بیماران COVID-19 مبتلا به ARDS، رسوبات اجزای کمپلمان ازجمله: کمپلکس حمله غشایی (C5b-9) ، C3 ، C4 و لکتین متصل به مانوز (MBL) مرتبط با سرین پروتئاز 2 (MASP2) را نشان میدهد. نتایج مطالعات حیوانی نشان داد که، موشهای دارای کمبود C3 و C4 نسبت به موشهای نوع وحشی اختلال عملکرد تنفسی و کاهش وزن بدن کمتری پیدا میکنند. بهعلاوه، فعال شدن C3 در ریهها یک روز پساز عفونت مشاهده شد. جالب است که یک آنتیبادی ضد C5 انسانی، (eculizumab) در بهبود پارامترهای بیماران موثر باشد.
کلیه
آسیب حاد کلیه ابتدا بهعنوان یک عارضه بالینی خارج ریوی از عفونت SARS-CoV-2 درنظر گرفته شد. همچنین درگیری کلیه برای اولینباردر گزارشاتی که جدا شدن ذرات ویروسی عفونی از ادرار بیماران را نشان دادند، مطرح شد. Chu و همکارانش نشان دادند که SARS-CoV-2 در چندین لاین سلولی کلیه تکثیر میشود. در این میان، ویروس بهطور وسیعی در سلولهای CRFK (گربه سانان) ، PK-15 (خوک) ، RK-13 (خرگوش) و LLCMK2 (میمون) تکثیر میشود. آنها همچنین تکثیر SARS-CoV-2 را در سلولهای کلیه جنینی انسان 293T مشاهده کردند. با این حال، آنها تشکیل CPE را فقط در ردههای سلولهای کلیوی پریماتی غیرانسانی Vero E6 و FRhK-4 مشاهده کردند، به این شکل که سلولهای آلوده به طور واضح دورهم جمع شده و از تکلایه جدا میشوند.
مطالعه اخیردیگری توسط Monteil و همکاران، همانندسازی قوس SARS-CoV-2 را در یک مدل ارگانوئید کلیه انسان نشان داد. چندین مطالعه RNA-seq، انواع مختلف سلول در کلیه را شناسایی کردند؛ که بیان گسترده ACE2 را نشان میدادند. اینها شامل: پودوسیتها، سلولهای اپیتلیال پاریتال گلومرولی، سلولهای اپیتلیال پایه و سلولهای اپیتلیال لولهای بودند. افزایش بیان TMPRSS2 و کاتپسین ال، (دو تسهیلگر مشکوک عفونت SARS-CoV-2) درچندین سلول در کلیه گزارش شده است. درواقع ، تجزیه و تحلیل میکروسکوپی الکترونی پساز مرگ بافت کلیه، وجود ذرات ویروسی را در توبولهای پروگزیمال همراه با تشکیل غیرعادی وزیکولهای دوغشایی نشان داد. آنالیز ایمونوهیستوشیمی، بیشتر توسط Diao و همکاران وجود ارتشاحات ماکروفاژ و لنفوسیتهای T CD8+ و همچنین رسوب قابل توجه اجزای کمپلمان C5b-9 را نشان داد، که نشانگرسندرم آزادسازی سیتوکین است. برای تعیین پاتولوژی، درک تعامل بین ایمنی میزبان و بافت کلیه آلوده، و درک انتشار بین سلولی SARS-CoV-2 در این اندام، مطالعات بیشتری لازم است.
کبد
آسیب کبدی در برخی از بیماران، با SARS-CoV-2 شدید گزارش شده است؛ دادههای موجود نشان میدهد که 2 تا 11 درصد بیماران COVID-19 همایندیهای کبدی دارند. این موضوع نشان میدهد که، این اندام یک محل بالقوه عفونت ثانویه برای SARS-CoV-2 است. نکته مهم آنکه، نارسایی کبدی قبلاً نیز در بیماران آلوده به SARS-CoV یا MERS-CoV گزارش شده است. بهطورمشخص، افزایش قابل توجه سطح آلانین آمینوترانسفراز (ALT) ، آسپارتات آمینوترانسفراز (AST) و سطح گاما-گلوتامیل ترانسفراز (GGT) دربیماران، با موارد شدید SARS-CoV-2 و همچنین مقدار بیلی روبین غیرطبیعی گزارش شده است.
اخیراً، تکثیر SARS-CoV-2 در رده سلولهای سرطان هپاتوسلولارانسانی Huh7 گزارش شده است. علاوه بر این، دو مطالعه جداگانه بر روی کتابخانههای توالی RNA در بافتهای انسانی، کلانژیوسیت را بعنوان یک هدف بالقوه برای عفونت SARS-CoV-2، به دلیل بیان زیاد ACE2 شناسایی کردند. این یافته توسط ژائو و همکارانش بااستفاده از یک مدل ارگانوئید مجرای کبدی انسان تایید شد؛ که در آن همانندسازی قوی SARS-CoV-2 را مشاهده کردند. اختلال در تنظیم بیان پروتئین اتصالات محکم claudin-1 و دو ناقل اسید صفراوی (حامل انتقال دهنده اسید صفراوی وابسته به سدیم آپیکال [ASBT] و تنظیم کننده هدایت تراغشایی سیستیک فیبروزیس (CFTR)) نیز مشاهده شد، که نشان دهنده نقص در اتصالات محکم و انتقال صفرا در کلانژیوسیتها به دلیل آلودگی با SARS-CoV-2 است. هنوز مشخص نیست که آیا آسیب کبدی در موارد شدید
SARS-CoV-2 به دلیل عفونت ویروسی است یا پاسخهای ایمنی بیشاز حد. آنالیز شبکههای برهمکنشی بین سلولی کلانژیوسیت نشان دهنده امکان پذیر بودن برهمکنشهای بین این سلولها و سلولهای کوپفر از طریق برهمکنش بین CD74 و فاکتورمهاری مهاجرت ماکروفاژ (MIF) است، که باعث ایجاد پاسخ پروالتهابی در اندامهای مختلف میشود. موضوع دیگر آن است که چگونه شرایط کبدی موجود، خطرعفونت شدید SARS-CoV-2 را افزایش میدهند. این بدان دلیل است که بیان ACE2 در کبد سیروزی به طور قابل توجهی تنظیم افزایشی میشود. برعکس، بیکوآرد و همکاران، بیماران مبتلا به بیماری کبد چرب متابولیکی را مورد بررسی قرار داده؛ و هیچ تغییر قابل توجهی در میزان بیان ACE2 یا TMPRSS2 در کبد گزارش نکردند. بنابراین، برای ارزیابی فعالیت سلولهای التهابی ساکن در کبد در طی عفونت SARS-CoV-2، همراه با رابطه بین تغییر در بیان گیرندههای SARS-CoV-2 و متابولیسم لیپید در کبد، به مدلهای پیشرفته عفونت نیاز است.
پانکراس
پانکراس نیز یک هدف بالقوه برای SARS-CoV-2 است. پانکراتیت در موش خرماهای آلوده به کوروناویروس موشی گزارش شده است. درمورد SARS-CoV-2، گزارشهای بالینی هیپرگلیسمی حاد و دیابت گذرا را در بیماران کووید-19 بدون سابقه دیابت نوع 2 توصیف کردهاند، که ممکن است نشان دهنده آسیب پانکراس باشد. قابل توجه است که لیو و همکاران، افزایش سطح آمیلاز و لیپاز را در سرم بیماران مبتلا به SARS-CoV-2 شدید مشاهده کردند؛ و برخی از این بیماران نیز تحت اسکن توموگرافی کامپیوتری، بزرگ شدن کانونی پانکراس و اتساع مجرای پانکراس را نشان دادند. علاوه بر این، ACE2 توسط جزایر پانکراس و غدد برون ریز نیز بیان میشود. این مشاهدات نشان میدهند که SARS-CoV-2 ممکن است، بهطورموقت جزایر لوزالمعده را آلوده کرده و متابولیسم گلوکز را مختل کند. درواقع ، یانگ و همکاران با استفاده از جزایر لوزالمعده مشتق شده از hPSC و شبه ویروسهای SARS-CoV-2 مبتنی بر ویروس استوماتیت وزیکولار، پذیرا بودن سلولهای آلفا و بتا لوزالمعده انسانی نسبت به SARS-CoV-2 را نشان دادند. برای تعیین اهمیت بالینی این مشاهدات و احتمالاً همچنین ارزیابی تأثیرعفونت برمتابولیسم بیماران، به مطالعات بیشتر نیاز است.
سیستم عصبی
دخالت کروناویروس انسانی، در بیماری عصبی از مدتها پیش پیشنهاد شده بود. برای مثال، کودک دارای نقص سیستمایمنی مبتلا به کرونا ویروس OC43، دچار انسفالیت پیشرونده کشنده شد. پتانسیل نروتروپیک کرونا ویروسهای OC43 و 229E از طریق عفونت آزمایشی چندین رده سلولی میکروگلیکال، اولیگودندروسیتی و آستروسیتی نشان داده شده است. علائم عصبی از جمله سردرد، گیجی و اختلال هوشیاری نیز دربرخی از بیماران دارای کووید 19 گزارش شده است. تکثیر نسبتا کم SARS-CoV-2 در سلولهای گلیوبلاستوما مشاهده شده است که میتواند نشان دهنده، پتانسیل نوروتروپیک این ویروس باشد. اخیرا، برخی از گروهها از مدل ارگانوئید مغز انسان، برای مطالعه پاتوفیزویولژی SARS-CoV-2 استفاده کردهاند. اگرچه تکثیر ناکافی SARS-CoV-2 را در این مدل مشاهده کردند، نشان دادند که SARS-CoV-2 جسم سلولی سلولهای عصبی قشر مغز را هدف قرار میدهد و همراه با بههم ریختن نظم tau در آکسونها و جسم سلولی است. آنها همچنین لوکالیزاسیون همراه ذرات SARS-CoV-2 با Tau فسفریله شده در تروئین 231 را مشاهده کردند، که با آپوپتوز عصبی همراه است و شاخص مراحل اولیه تخریب عصبی است.
مسیرهای مختلفی برای تهاجم عصبی ویروس کرونا پیشنهاد شده است. تلقیح انترانازال موشهای تراریخته با SARS-CoV بیان کننده ACE2، باعث انتشار نورونی درمغز از طریق پیاز بویایی شد. در مغز انسان، ACE2 عمدتا در نورونها، آستروسیتها و الیگودندروسیتهای شکنج گیجگاهی میانی و قشر سینگولار خلفی و همچنین سلولهای عضله صاف اندوتلیال و آرتریال (شریانی) دیده میشود. برخلاف موش، ACE3 و TMPRSS2 در نورونهای حسی و پیاز بویایی انسان بیان نمیشوند. با این حال، آنها درسلولهای پشتیبان، سلولهای پایه بویایی و سلولهای اطراف عروقی دیده میشوند. این مشاهدات نه تنها احتمال ورود SARS-CoV-2 از داخل بینی به مغز انسان را نشان میدهد؛ بلکه میتواند، شروع هیپوسمی و هیپوژئوزی گزارش شده در مراحل اولیه SARS-CoV-2 را توضیح دهد. %




