دستورالعملهای بهروزرسانی شده سال 2020 انجمن جهانی جراحی اورژانسی برای تشخیص و درمان کوله سیستیت کالکولوس حاد
کوله سیستیت کالکولوس حاد (ACC)، درجمعیت عمومی بروز بالایی دارد. وجود چندین حوزه عدم قطعیت، همراه با فراهمی شواهد جدید، ما را برآن داشت، دستورالعملهای سال 2016 WSES (انجمن جهانی جراحی اورژانسی) درباره ACC را بهروزرسانی کنیم.
مواد و روشها: رئیس WSES چهار عضو را در دبیرخانه علمی، چهار عضو را بهعنوان کمیته سازماندهی، و چهار عضو را بهعنوان کمیته علمی منسوب کرد، و آنها را از متخصصین WSES انتخاب نمود. سوالات کلیدی مربوطه تهیه شده و نیروی کار، پیشنویسهایی از هربخش براساس بهترین شواهد علمی بهدست آمده از PubMed و کتابخانه EMBASE تهیه کردند؛ توصیهها بهمنظور پاسخ به این سوالات کلیدی توسعه یافتند. کیفیت شواهد و قدرت توصیهها با استفاده از معیارهای ارزیابی، توسعه و ارزشیابی توصیهها (GRADE) بررسی شدند (https://www.gradeworkinggroup.org را ببینید). همه بیانیهها درطول کنفرانس، اجماع در ششمین کنگره جهانی انجمن جهانی جراحی اورژانسی که در ماه می سال 2019 در نایگمن (NL) برگزار شد ارائه شده، موردبحث، و رایگیری قرار گرفتند. نسخه بازنگری شده بیانیهها، توسط یک پرسشنامه آنلاین تا زمان اجماع به رای گذاشته شد.
نتایج: نقش حیاتی جراحی ازجمله در بیماران پرخطر تایید شد. درمقایسه با دستورالعملهای سال 2016، نقش درناژ کیسه صفرا علیرغم فراهمی بهبودهای تکنیکی قابلتوجه، کاهش یافت. کوله سیستکتومی لاپاروسکوپیک زودهنگام (ELC) باید درصورت امکان استاندارد مراقبتی باشد، حتی در زیرگروهی از بیماران که نحیف درنظر گرفته میشوند مثلا سالمندان، بیماران دارای بیماری قلبی، بیماری کلیوی و سیروز، یا انهایی که معمولا درمعرض ریسک زیاد جراحی قرار دارند. کوله سیستکتومی ساب توتال ایمن بوده؛ و یک گزینه باارزش درمواردی است که خارج کردن کیسه صفرا دشوار است.
نتیجهگیری، شکافهای دانش، و توصیههای پژوهشی: ELC نقش محوری درمدیریت بیماران دارای ACC دارد. ارزش درمان جراحی در بیماران پرخطر، باید منجربه تمایز بین بیماران درمعرض ریسک زیاد و بیمارانی که برای جراحی مناب نیستند شود. شواهد بیشتر درباره نقش قضاوت بالینی و استفاده از نمرههای بالینی بهعنوان ابزار کمکی برای هدایت درمان بیماران با ریسک زیاد و بیمارانی که برای جراحی مناسب نیستند، نیاز میباشد. توسعه سیاستهای محلی برای کوله سیستکتومی لاپاروسکوپیک ایمن، توصیه میگردد.
پس زمینه
شیوع کلی برآورد شده سنگ کیسه صفرا درجمعیت عمومی 10 تا 15 درصد است، و تفاوتهایی درکشورهای مختلف وجود دارد. بین 20 تا 40 درصد از بیماران دارای سنگ کیسه صفرا، دچار عوارض مرتبط با سنگ کیسه صفرا میشوند و بروز آن سالانه 1 تا 3 درصد است؛ کوله سیستیت کالکولوس حاد، (ACC) اولین تظاهر بالینی در 10 تا 15 درصد موارد است. کوله سیستکتومی رایجترین رویکرد درمانی ACC است؛ و دربیشتر بیماران استاندارد مراقبتی بیماری سنگ کیسه صفرا درنظر گرفته میشود. با این حال، با توجه به ناهمگونی سناریوهای بالینی، تفاوت در امکانات بیمارستانی و در دسترس بودن متخصصین، مدیریت بیماران دارای درد در یک چهارم فوقانی راست شکم متغیر است.
در سال 2016، انجمن جهانی جراحی اورژانسی، (WSES) اولین ویرایش از دستورالعملهای ACC خود را منتشر کرد، که الگوریتمهای تشخیصی و درمانی متفاوتی نسبت به دستورالعمل توکیو (TG) ارائه نمود، که در آن زمان دستورالعملهای سال 2013 توکیو (TG13) نامیده میشد. بهطور خاص، ارتباط مستقیم بین معیارهای تشخیصی ACC، طبقهبندی شدت، و اندیکاسیونهای درمانی شرح داده شده در TG13 بهدلیل نبود شواهد باکیفیت محدود هستند. رویکرد دستورالعملهای WSES، ساده سازی مدیریت اولیه بیمارانی است که با ACC مشکوک مراجعه میکنند. بررسی مقالات، بحث درباره شواهد مرتبط، و بیانههای ارائه شده درطول کنفرانس اجماع (CC) برگزار شده درسال 2015 در اورشلیم (سومین کنگره بینالمللی WSES)، با دو استثنا از جراحی بهعنوان درمان استاندارد طلایی برای همه بیماران ACC پشتیبانی میکند: بیمارانی که جراحی را رد میکنند، و بیمارانی که جراحی در آنها با ریسک بسیارزیاد درنظر گرفته میشود؛ اگرچه هیچ اجماع روشنی درباره مساله دوم بهدست نیامد. علاوهبر این، دستورالعملهای سال 2016 WSES درباره ACC شامل بحث درباره، حوزههای غیرشفاف همچون تشخیص، ارزیابی ریسک جراحی، و مدیریت مناسب سنگهای مرتبط مجرای صفراوی اصلی (CBDS) بودند.
در سال 2017، WSES باهدف بررسی این زیرگروه از بیماران نحیف، که درمعرض ریسک بسیارزیاد جراحی درنظر گرفته میشوند درطول یک CC درباره مدیریت ACC درسالمندان به انجمن جراحی سالمندان ایتالیا پیوست. توافقی در حمایت از مدیریت ACC با جراحی درسالمندان بهدست نیامد؛ و سن بالا بهعنوان منعی برای خود جراحی درنظر گرفته شد. محققان نبود مطالعات باکیفیت زیاد دراین حوزه را گزارش کردند.
WSES بعداز ارزیابی ویرایش 2018 TG (TG18) درباره ACC، متوجه شد که این ویرایش جدید به نتیجهگیریهایی رسیده که به توصیههای دستورالعملهای ACC سال 2016 WSES بهخصوص ازنظر اندیکاسیون آزادانهتر جراحی شامل ACC درجه 3 نزدیکتر است. با این حال، هنوز به هنگام مقایسه دستورالعملهای WSES و TG (همه ویرایشها) تفاوتهایی باقیمانده، که در توصیههای مربوط به دستورالعملهای بهروزرسانی شده کنونی مشهود است. برگزاری یک رویداد ترکیبی توسط WSES و گروه TG فرصتی برای به اشتراکگذاری تجربیات، از نقطه نظرهای متفاوت خواهد بود.
از زمان انتشار دستورالعملهای WSES 2016 و TG18، مدیریت بیماران پرخطر دارای ACC در یک کارآزمایی کنترل شده تصادفی، (RCT) که کارآزمایی CHOCOLATE نامیده میشود بررسی شده است. لوزن و همکارانش، کوله سیستکتومی را با درناژ توسط کاتتر زیرجلدی در بیماران دارای ریسک زیاد جراحی مقایسه کردند. این گروه پژوهشی در این ویرایش دستورالعملهای ACC WSES، به سایر متخصصین پیوستهاند.
بخش 1. تشخیص ACC
1.1 چون هیچکدام از ویژگیها توان تشخیصی کافی برای تعیین یا رد تشخیص ACC ندارند، توصیه میشود به یک یافته بالینی یا آزمایشگاه اتکا نشود. (QoE: زیاد؛ SoR: قوی)
1.2 برای تشخیص ACC، پیشنهاد میکنیم از ترکیبی از شرح حال دقیق، معاینه بالینی کامل، تستهای آزمایشگاهی و بررسیهای تصویربرداری استفاده شود. با این حال، بهترین ترکیب مشخص نیست. (QoE: بسیار کم؛ SoR: ضعیف)
نکته: ویژگیهای سودمند برای تشخیص ACC عبارتنداز:
- شرح حال و معاینه بالینی: تب، درد یا حساسیت در یک چهارم بالا راست شکم، استفراغ یا عدم تحمل غذا؛ علائم مورفی
- تستهای آزمایشگاهی: افزایش پروتئین واکنشی C، افزایش تعداد گلبول سفید خون
- تصویربرداری: علائم نشاندهنده التهاب کیسه صفرا
کدام تکنیک تصویربرداری اولیه باید در موارد ظن به تشخیص ACC استفاده شود؟
1.3 توصیه میکنیم از اولتراسوند (US) شکم بهعنوان تکنیک تصویربرداری ترجیحی اولیه استفاده شود، زیرا مقرون بهصرفه بوده، به طور گسترده دردسترس قرار دارد، تهاجم کم و دقت خوبی برای بیماری سنگ کیسه صفرا دارد. (QoE: زیاد؛ SoR: قوی)
نکته: US شکم یک روش بررسی قابل اعتماد است؛ با این حال در تایید یا رد تشخیص ACC، براساس معیارهای US اتخاذ شده کاربرد محدودی دارد.
نقش سایر تکنیکهای تصویربرداری (مثلا اسکن ایمینودی استیک اسید هپاتوبیلیاری (HIDA)، اسکن توموگرافی کامپیوتری شکم (CT)، و تصویربرداری رزونانس مغناطیسی (MRI) در تشخیص ACC چیست؟
1.4 پیشنهاد میکنیم در بیماران انتخابی بسته به تخصص و فراهمی محلی، از سایر تکنیکهای تصویربرداری برای تشخیص ACC استفاده شود. اسکن HIDA بیشترین حساسیت و اختصاصیت را در تشخیص ACC در مقایسه با سایر روشهای تصویربرداری دارد. دقت تشخیصی CT ضعیف است. تصویربرداری رزونانس مغناطیسی، به اندازه US شکمی دقیق است. (QoE: متوسط؛ SoR: قوی)
نکته: در شرایط بالینی، استفاده از اسکن HIDA به دلیل منابع و زمان موردنیاز محدود است.
بخش 2: سنگهای مرتبط مجرای صفراوی اصلی: کدام ابزارها برای ظن و تشخیص در زمان تظاهر استفاده شوند؟
کوله دوکو لیتیازیس، یعنی وجود سنگ درمجرای صفراوی اصلی (CBDS)، در 10 تا 20 درصد موارد سنگ کیسه صفرا رخ میدهد، و درمورد ACC بروز آن کمتر و بین 5 تا 15 درصد است. بررسی ازنظر CBDS نیازمند زمان است؛ و ممکن است درمان با جراحی را به تاخیر بیاندازد. بهدلیل بروز نسبتا کم CBDS درطول ACC، مشکل اصلی انتخاب بیماران دارای احتمال CBDS زیاد است، که از تستهای تشخیصی و خارج کردن بعدی CBDS سود میبرند. یک شرایط غیرمعمول که از CBDS تقلید میکند، سندرم میریزی است که درکمتراز 1% بیماران دارای سنگ کیسه صفرا رخ میدهد. بررسیهای قبلاز عمل در تشخیص کمک میکنند، اگرچه اکثریت موارد درطول جراحی شناسایی میشوند.
تنها مطالعه جدید درباره این موضوع، یک مطالعه مقطعی درباره نقش تستهای عملکرد کبد (LFTs) است. محققان نقش LFTها و نقش فالوآپ اولیه در تشخیص CBDS در ACC را ارزیابی کردند. قابل اعتمادترین LFT گاما-گلوتامیل ترانس پپتیداز (GGT) بود که حساسیت 80.6 و اختصاصیت 75.3 درصدی بااستفاده از مقدار کات آف 224 واحد بینالمللی برلیتر داشت. PPV 50% بود، درحالی که NPV 91.4% بود. نتایج کاهش معنیدار LFTها را درگروههای غیر CBD در 4 روز فالوآپ نشان داد، که درگروه ACC+CBDS جز درمورد آلانین آمینوترانسفراز مشهود نبود. علاوهبر این، درگروه CBDS، همه مقادیر LFT بعداز حذف CBDS در میانگین زمان فالوآپ 4.3 روزه بهطور معنیداری بهبود یافتند.
یکیاز معایب این مطالعه این است که تشخیص ایندکس تاحدی وابسته به استاندارد مرجع میباشد. باتوجه به طراحی گذشتهنگر مطالعه، باید درنظر گرفت که تشخیص CBDS با کولانژیو-پانکراتوگرافی رتروگراد اندوسکوپیک (ERCP) ارزیابی شد که عمدتا باحضور LFTهای افزایشیافته انجام میشود؛ این مساله ممکن است یکی از منابع سوگیری باشد. هیچ کولانژیوگرافی حینعمل سیستماتیکی (IOC) انجام نشد.
آیا افزایش LFTها یا بیلی روبین برای تشخیص CBDS در بیماران دارای ACC کافی است؟
2.1 ما مخالف استفاده از افزایش LFTها یا بیلی روبین بهعنوان تنها روش شناسایی CBDS در بیماران مبتلا به ACC هستیم؛ و دراین مورد توصیه میکنیم تستهای تشخیصی بیشتری انجام دهید. (QoE: متوسط؛ SoR: قوی)
کدام ویژگیهای تصویربرداری پیش بینی کننده CBDS در بیماران مبتلا به ACC هستند؟
2.2 پیشنهاد میکنیم مشاهده سنگ در مجرای صفراوی اصلی را در US ترانس ابدومینال بهعنوان پیشبینی کننده CBDS در بیماران مبتلا به ACC درنظر بگیرید. (QoE: بسیار کم؛ SoR: ضعیف)
2.3 افزایش قطر مجرای صفراوی اصلی، یکی از علائم غیرمستقیم وجود سنگ بوده و برای شناسایی بیماران ACC دارای CBDS کافی نیست؛ و بنابراین انجام تستهای تشخیصی بیشتر را توصیه میکنیم. (QoE: زیاد؛ SoR: قوی)
کدام تستها باید برای ارزیابی ریسک CBDS در بیماران ACC استفاده شوند؟
2.4 بهمنظور ارزیابی رسک CBDS، پیشنهاد میکنیم، تست عملکرد کمد (LFTs)، شامل ALT، AST، بیلی روبین، ALP، GGT، و US شکمی را در همه بیماران ACC انجام دهید. (QoE: کم؛ SoR: ضعیف).
بهترین ابزار طبقهبندی ریسک CBDS در بیماران ACC کدام است؟
2.5 پیشنهاد میکنیم ریسک CBDS براساس طبقهبندی پیشنهادی اصلاح شده انجمن اندوسکوپی دستگاه گوارش آمریکا، و دستورالعملهای انجمن اندوسکوپی گوارشی آمریکا انجام شود. (QoE: بسیار کم؛ SoR: ضعیف).
در بیماران مبتلا به ACC و درمعرض ریسک متوسط CBDs چه اقداماتی ضروری است؟
2.6 توصیه میکنیم که بیماران دارای ریسک متوسط CBDS تحت یکیاز موارد زیر قرار گیرند: کولانژیوپانکراتوگرافی رزونانس مغناطیسی قبلاز جراحی (MRCP)، اولتراسوند اندوسکوپیک قبلاز عمل (EUS)، کولانژیوگرافی حینعمل (IOC)، یا اولستراسوند لاپاروسکوپیک (LUS) بسته به فراهمی و تخصص محلی. (QoE: زیاد؛ SoR: قوی)

کدام اقدامات در بیماران مبتلا به ACC و درمعرض ریسک بالای CBDS نیاز میباشند؟
2.7 توصیه میکنیم بیمار درمعرض ریسک زیاد CBDS تحت ERCP، IOC، یا LUS قبلاز عمل، بسته به تخصص محلی و فراهمی تکنیک قرار گیرند. (QoE: زیاد؛ SoR: قوی)
کدام درمان CBDS در بیماران ACC مناسب است؟
2.8 توصیه میکنیم CBDS قبلاز عمل، حینعمل، یا بعداز عمل براساس تخصص محلی و فراهمی تکنیکهای مختلف خارج شود. (QoE: زیاد؛ SoR: قوی)
بخش 3: درمان ACC با جراحی
ادبیات بهروزرسانی شده بعداز دستورالعملهای سال 2016 WSES ACC، هیچ مقاله قابل توجهی برای تغییر بیانیههای قبلی ویرایش شده توسط WSES درسال 2016 را نشان نمیدهد؛ با این حال، برای اطمینان از بهترین شواهد موجود بررسی شدند.
درمان خط اول ترجیحی برای بیماران ACC کدام است؟
چه زمانی باید از کوله سیستکتومی لاپاروسکوپیک در بیماران ACC اجتناب کرد؟
3.1 کوله سیستکتومی لاپاروسکوپیک را بهعنوان درمان خط اول، در بیماران مبتلا به ACC توصیه میکنیم. (QoE: زیاد؛ SoR: قوی).
نکته: نرخ کم عوارض و بستری کوتاه در بیمارستان از مزایای اصلی هستند.
3.2 اجتناب از کوله سیستکتومی لاپاروسکوپیک را درموارد شوک سپتیک یا منع مطلق بیهوشی توصیه میکنیم (QoE: زیاد؛ SoR: قوی)
آیا کوله سیستکتومی لاپاروسکوپیک برای بیماران ACC دارای سیروز کبدی بالای 80 سال یا باردار، ایمن و امکانپذیر است؟
3.3 انجام کوله سیستکتومی لاپاروسکوپیک را برای بیماران ACC دارای سیروز A و B، بیماران دارای سن بالا (بالای 80 سال)، و بیماران باردار توصیه میکنیم. (QoE: کم؛ SoR: ضعیف).
کدام استراتژیهای جراحی باید درموارد شناسایی آناتومیک دشوار ساختارها درطول کوله سیستکتومی بهدلیل ACC اتخاذ شوند؟
3.4 کوله سیستکتومی ساب توتال باز یا لاپاروسکوپیک را در وضعیتهایی که شناسایی آناتومیک دشوار بوده؛ و ریسک آسیبهای ایاتروژنیک زیاد است توصیه میکنیم. (QoE: متوسط؛ SoR: قوی)
چه زمانی باید تبدیل از کوله سیستکتومی لاپاروسکوپیک به باز را در بیماران ACC درنظر گرفت؟
3.5 توصیه میکنید درموارد التهاب محلی شدید، چسبندگی، خونریزی از مثلث کالوت یا ظن به آسیب مجرای صفراوی تبدیل از کوله سیستکتومی لاپاروسکوپیک به باز صورت گیرد. (QoE: متوسط؛ SoR: قوی)
بخش 4: زمان بندی کوله سیستکتومی درافراد مبتلا به ACC
چه زمانی برای کوله سیستکتومی لاپاروسکوپیک در بیماران ACC بهینه است؟
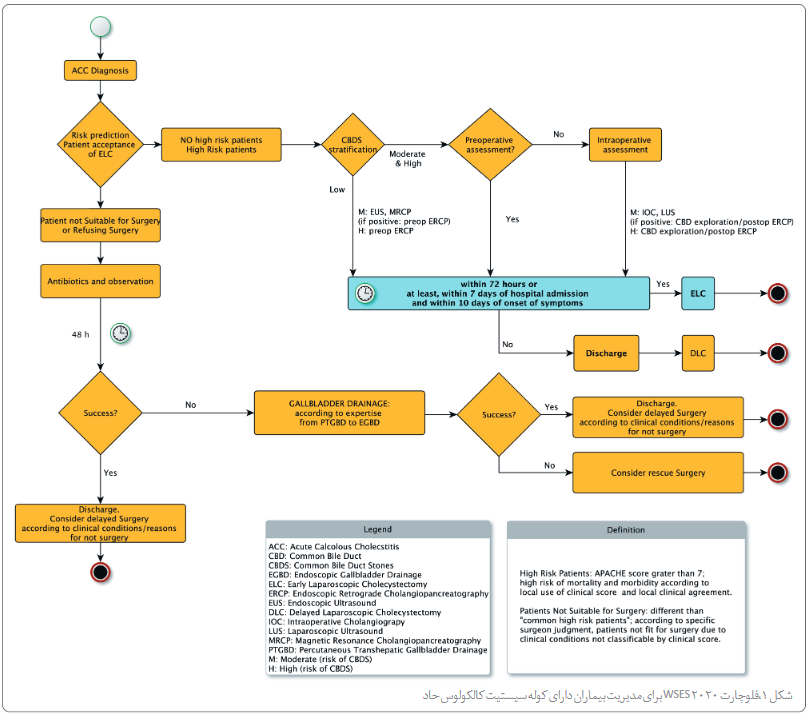
4.1 درصورت وجود تجربه جراحی کافی، توصیه میکنیم ELC درسریعترین زمان ممکن در 7 روز از زمان بستری در بیمارستان، و 10 روز از زمان شروع نشانهها انجام شود. (QoE: متوسط؛ SoR: قوی)
نکته: ELC بهصورت تعریف شده به کوله سیستکتومی لاپاروسکوپیک حدواسط (ILC، انجام شده بین هفت روز تا 6 هفته از زمان بستری) و DLC (انجام شده بین 6 هفته تا 3 ماه) ترجیح داده میشود.
4.2 توصیه میکنیم درصورتی که نتوان ELC را انجام داد، DLC بعد از 6 هفته از تظاهر بالینی اولیه انجام شود. (QoE: بسیار کم؛ SoR: ضعیف)
بخش 5. پیشبینی ریسک در ACC
چگونه میتوان پیشآگهی و ریسک جراحی را برای بیماران مبتلا به ACC ارزیابی کرد؟
5.1 نمیتوانیم استفاده ازهیچکدام از مدلهای پیشآگهی را در بیماران مبتلا به ACC توصیه نماییم. (QoE: بسیار کم؛ SoR: ضعیف).
نکته: درحالحاضر در توانایی فاکتورهای پیشآگهی و مدلهای پیشبینی ریسک در پیشبینی نتایج در بیماران ACC به صورت قابل توجهی عدم قطعیت وجود دارد.
بخش 6 درمان جایگزین برای بیماران دارای ACC که برای جراحی مناسب نیستند: مشاهده و تکنیکهای درناژ کیسه صفرا
چه زمانی باید مدیریت غیرجراحی را در بیماران ACC درنظر گرفت؟
6.1 پیشنهاد میکنیم NOM، یعنی بهترین درمان پزشکی با آنتیبیوتیک؛ و مشاهده را برای بیمارانی که جراحی را ردکرده یا آنهایی که برای جراحی مناسب نیستند، درنظر بگیرید. (QoE: کم؛ SoR: ضعیف)
6.2 پیشنهاد میکنیم گزینههای درمانی جایگزین را برای بیمارانی که NOM در آنها موفق نبوده و همچنان جراحی را رد میکنند؛ یا بیمارانی که برای جراحی مناسب نیستند درنظر بگیرید. (QoE: کم؛ SoR: ضعیف)
کدام درمان در بیماران دارای ریسک زیاد انتخاب اول است؟
6.3 کوله سیستکتومی لاپاروسکوپیک فوری در بیماران ACC دارای ریسک زیاد بهتراز درناژ زیرجلدی تراکبدی کیسه صفرا (PTGBD) است. کوله سیستکتومی لاپاروسکوپیک را بهعنوان درمان انتخاب اول در این گروه از بیماران توصیه میکنیم. (QoE: زیاد؛ SoR: قوی)
نقش درناژ کیسه صفرا در بیماران مبتلا به ACC که برای جراحی مناسب نیستند چیست؟
6.4 انجام درناژ کیسه صفرا را در بیماران مبتلا به ACC که برای جراحی مناسب نیستند توصیه میکنیم، زیرا یک بیمار ACC سپتیک را به یک بیمارغیرسپتیک تبدیل میکند. (QoE: متوسط؛ SoR: قوی)
آیا باید کوله سیستکتومی تاخیری را بعداز کاهش ریسک حول و حوش عمل به بیماران ACC ارائه نمود؟
6.5 کوله سیستکتومی لاپاروسکوپیک تاخیری بعداز کاهش ریسکهای حول و حوش عمل برای کاهش بتسری مجدد ناشیاز عود ACC، یا بیماری مرتبط با سنگ کیسه صفرا پیشنهاد میشود. (QoE: بسیار کم؛ SoR: ضعیف).
آیا درناژ اندوسکوپیک کیسه صفرا را میتوان جایگزینی برای PTGBD در بیماران ACC که برای جراحی مناسب نیستند درنظر گرفت؟
6.6 در بیماران ACC که برای جراحی مناسب نیستند، درناژ اندوسککوپیک ترانس پاپیلاری کیسه صفرا (ETGBD) یا درناژ ترانس مورال هدایت شده توسط اولتراسوند کیسه صفرا (EUS-GBD) درصورت انجام درمراکز با حجم بالا و توسط اندوسکوپیست ماهر باید جایگزینهای ایمن و کارآمد PTGBD درنظر گرفته شوند. (QoE: زیاد؛ SoR: قوی).
6.7 اگر درناژ اندوسکوپیک ترانس پاپیلاری کیسه صفرا انجام شود، هم درناژ اندوسکوپیک نازوگاستریک کیسه صفرا (ENGBD) و هم استنت گذاری اندوسکوپیک کیسه صفرا (EGBS) باید براساس ویژگیهای بیمار و تصمیم اندوسکوپیک گزینههای مناسب درنظر گرفته شوند. (QoE: زیاد؛ SoR: قوی)
نقش درناژ اندوسکوپیک ترانس مورال هدایت شده توسط اولتراسوند کیسه صفرا (EUS-GBD) در بیماران ACC که برای جراحی مناسب نیستند، چیست؟
6.8 EUS-GBD با استنتهای فلزی خود منبسط شونده لومن (LAMPs) درصورت انجام توسط اندوسکوپیک ماهر باید به ETGBD ترجیحداده شوند. (QoE: متوسط؛ SoR: قوی)
6.9 اگر EUG-GBD بااستفاده از استنتهای فلزی انجام شود، توصیه میکنیم در 4 هفته خارج شود تا از گیرافتادن موادغذایی و ریسک زیاد بعدی عود ACC جلوگیری شود. (QoE: کم؛ SoR: ضعیف)
بخش 7 درمان آنتیبیوتیکی ACC
کدام درمان آنتیبیوتیکی برای بیماران دارای ACC بدونعوارض بهینه است؟
7.1 در ACC بدون عارضه، مخالف استفاده روتین از آنتیبیوتیکهای بعداز عمل درصورت کنترل کانون عفونت توسط کوله سیستکتومی هستیم. (QoE: زیاد؛ SoR: قوی)
درمان آنتیبیوتیکی بهینه برای بیماران دارای ACC بغرنج چیست؟
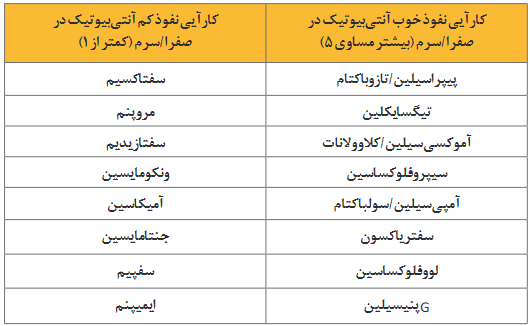
7.2 در ACC بغرنج، تجویز رژیم ضدمیکروبی، براساس پاتوژنهای احتمالی دخیل و ریسک فاکتورهای الگوهای مقاومت ماژور را توصیه میکنیم. (QoE: زیاد؛ SoR: قوی)
نقش کشت و حساسیت میکروبیولوژیکی در بیماران ACC چیست؟
7.3 در بیماران دارای ACC بغرنج و بیماران درمعرض ریسک زیاد مقاومت ضدمیکروبی، اتخاذ رژیم آنتیبیوتیکی هدفمند براساس نتایج آنالیز میکروبیولوژیکی و اطمینان از پوشش ضدمیکروبی کافی را توصیه میکنیم. (QoE: متوسط؛ SoR: ضعیف)
نتیجهگیریها، شکافهای دانشی، و توصیههای تحقیقاتی
WSES 2020 درباره ACC، براساس شواهد بهروزرسانی شده، نقش حیاتی ELC درمدیریت ACC را حتی در بیماران با ریسک بالا تقویت میکند. بهعقیده ما الگوریتم تازه توسعهیافته براهمیت دو دسته از بیماران تاکید دارد: بیماران با ریسک زیاد و آنهایی که برای جراحی مناسب نیستند.
مطالعه CHOCOLATE بیماران پرخطرهمچون بیماران دارای نمره APACHE بین 7 تا 14 را تعریف میکند؛ این مطالعه باکیفیت زیاد درک ما از مدیریت این کوهورت پیچیده از بیماران را بهبود بخشید. نتایج آن بهنفع جراحی درمقایسه با درناژ صفراوی در بیماران با ریسک زیاد ACC هستند. با این حال، یک تعریف واحد و پذیرفته شده جهانی از این گروه بیماران با ریسک زیاد وجود ندارد؛ بنابراین، باپذیرش پیشنهاد لوزن و همکاران، توصیه به توسعهی مسیرهای بالینی محلی بعداز تصمیمگیری درباره این که کدام نمرههای موجود با نیازها و تخصص محلی تطابق دارند، منطقی بهنظر میرسد.
علاوهبر بیماران پرخطر تعریف شده، WSES دستهبندی از بیماران که برای جراحی مناسب نیستند را نیز پیشنهاد میکند. پیشنهاد میکنیم همه بیماران ACC که براساس قضاوت جراح، برای جراحی مناسب نیستند؛ و بیمارانی که بهدلیل وجود شرایط بالینی غیرقابل طبقهبندی با نمرههای بالینی یا فیزیولوژیک، برای جراحی مناسب نمیباشند را در ایندسته قرار دهید. در این کوهورت از بیماران، جراحی ممکن است غیرایمن یا غیرممکن باشد و درناژ کیسه صفرا مناسبترین گزینه موجود در موارد سپسیس کنترل نشده و/یا شکست NOM است.
علاوهبر این، حوزههای مهم پژوهشهای آتی نیز شناسایی شدند. این حوزهها عبارتنداز: (1) مطالعات با کیفیت بالا درباره فاکتورهای پیشآگهی بیماران ACC بهمنظور بهبود تصمیمگیری مشترک؛ (2) تعریف بهترین گزینه مدیریتی درصورت عدمامکان ELC، بهدلیل نبود تخصص بالینی یا مدت زمان نشانهها. این پژوهشها باید شامل تمرکز روی گروههای شامل بیماران و پزشکان، و استفادهاز مطالعات مشاهداتی باشند، و (3) تعریف بهترینگزینه در مدیریت سناریوهای جراحی دشوار. این کار نیازبه یک زبان مشترک بین محققان بهمنظور کسب مطالعات باکیفیت بیشتر دارد (ازنظر طبقهبندی مشکلات: مثلا چسبندگی در احشای توخالی، مشکلات گراسپینگ کیسه صفرا، مشکلات مربوط به ایمنی، قانقاریای مجرای سیستیک، وغیره).
درنهایت، WSES قویا طرفدار اتخاذ سیاستی برای کوله سیستکتومی لاپاروسکوپیک ایمن است و براساس شواهد موجود، توسعه مسیرهای محلی (local) را تشویق میکند.