- شرح حال
دکتر نیل دی فرناندس: پسری 29 ماهه به دلیل تشنج و هیپوکلسمی به این بیمارستان منتقل شد. تقریباً 2 ماه قبل از مراجعه، بیمار دچار تشنج تبدار همراه با یک بیماری حاد ویروسی شده بود. پس از تشنج، مادر وی گزارش داد که راه رفتن اردکوار (waddling) وی بارزتر شده است. دو هفته قبل از مراجعه فعلی، بیمار به کلینیک ارتوپدی در بیمارستان دیگری مراجعه کرده بود. در معاینه آزمایش cover-up – که در آن قسمت پایینی دیستال پا پوشانده شده و همترازی پروگزیمال پایین ساق پا با قسمت فوقانی پا مقایسه می شود – منفی بود که یک نتیجه مطابق با خم شدن فیزیولوژیک پا محسوب میشود. یک دفورمیتی pes planus (flatfoot) وجود داشت که وقتی بیمار تحمل وزن روی پا نداشت برطرف میشد و یک زاویه اکسترنال (مثبت) پا همراه با آمبولاسیون (ambulation) وجود داشت. به مادر گفته شده بود که یافتهها در زمینهی راه رفتن و رشد اسکلتی-عضلانی طبیعی است. یک روز قبل از مراجعه فعلی، مادر متوجه شد که وقتی کودک بر روی لبه راه میرود، پاهای کودک “قفل شده” است و “لرزان” به نظر می رسد.
صبح روز مراجعه، مادر بیمار متوجه شد که کودک هنگام خواب دچار غرولند (grunting) شده و چشمهایش را به سمت بالا چرخانده و بازوهایش سفت و خم شد. بعد از کمتر از 1 دقیقه، ناراحتی و حرکات متوقف شد و بیمار استفراغ کرد. با خدمات فوریتهای پزشکی تماس گرفتهشد و بیمار به بخش اورژانس بیمارستان دیگری منتقل شد. علائم حیاتی، وضعیت ذهنی و یافتههای معاینه طبیعی گزارش شده است. ارزیابی آزمایشگاهی از نظر میزان کلسیم خون 5 میلیگرم در دسی لیتر (1.25 میلیمول در لیتر؛ دامنه نرمال، 8.5 تا 10.5 میلی گرم در دسی لیتر [2.12 تا 2.62 میلی مول در لیتر]) قابل توجه بود. گلوکونات کلسیم داخل وریدی تجویز شد. بیمار تقریباً 18 ساعت پس از تشنج احتمالی به بخش اورژانس این بیمارستان منتقل شد.
شرح حال بیشتر از والدین بیمار گرفته شد. بیمار ترم زایمان شده بود و مراحل رشد مربوط به سن خود را به موقع پشت سر گذاشتهبود. سابقه درماتیت آتوپیک داشت که در سن 9 هفتگی تشخیص داده شدهبود؛ و همچنین چندین مورد آلرژی محیطی و غذایی داشت. یک سال قبل، ارزیابی توسط متخصص آلرژی نشان داد که سطح آزمایشات IgE مخصوص مواد آلرژی زا (شیر، بادام هندی، پسته، سفیده تخم مرغ، بادام، سویا، نخود، نخود سبز، عدس، بادام زمینی و دانه کنجد) و آلرژنهای محیطی افزایش یافتهاست ( سگ، گربه، کنه و گرد و غبار)؛ اگرچه بعداً بیمار در یک کلینیک آلرژی تحت چالش غذایی نسبت به بادام زمینی، حبوبات، بادام و دانه کنجد قرار گرفت و هیچ علائمی نداشت. هیچ آلرژی دارویی شناختهشدهای وجود نداشت. بیمار در صورت نیاز دیفنهیدرامین، هیدروکسیزین ، اپینفرین و بتامتازون موضعی دریافت کردهبود. او به علت امتناع والدینش، هیچ واکسیناسیون معمول کودکی را دریافت نکرده بود.
بیمار با مادر، پدر، دو خواهر و برادر بزرگتر و سگشان در نیوانگلند زندگی میکرد. اگرچه مادر گیاهخوار بود، اما گاهی اوقات مرغ را در رژیم طبیعی و ارگانیک بیمار قرار میداد. مادر بیمار دچار اختلال وسواس فکری و اضطراب بود و پدر وی دارای سندرم آلرژی دهانی و سابقه واروس زانو در دوران کودکی بود. دو خواهر و برادر بیمار دارای درماتیت آتوپیک، آلرژی محیطی و آلرژی غذایی بودند. سابقه خانوادگی تشنج وجود نداشت. در معاینه بیمار حال عمومی خوب و هوشیار بود و تعامل داشت. دما 36.9 درجه سانتی گراد، قد 83.5 سانتی متر (صدک 3 برای سن او) و وزن 12.4 کیلوگرم (صدک 24 برای سن او) بود. فشار خون 63/95 میلی متر جیوه، نبض 114 ضربان در دقیقه، سرعت تنفس 24 تنفس در دقیقه و اشباع اکسیژن 99٪ در حالی که بیمار هوای محیط را تنفس میکرد، بود. اسپاسم عضلات با حرکت غیرفعال در بازوها و پاها رخ داد. علائم Chvostek (انقباض عضلات صورت) پس از ضربه زدن بر ناحیه عصب صورت که قدام کانال شنوایی خارجی است، ایجاد نشد. علائم Trousseau (اسپاسم کارپال) پس از اعمال فشار ناشی از فشارسنج بر روی بازو ایجاد نشد. قدرت عضله، حجم، تن و رفلکسهای تاندون عمیقی مانند سایر معاینات طبیعی بود.
سطح کلسیم خون 5.6 میلیگرم در دسیلیتر (1.40 میلی مول در لیتر)، سطح کلسیم یونیزه 0.88 میلیمول در لیتر (محدوده نرمال، 1.14 تا 1.30) و سطح آلکالن فسفاتاز U/Liter 673 (محدوده نرمال، 142 تا 335). نتایج دیگر آزمایشات در جدول 1 نشان داده شدهاست. بیمار در بخش مراقبتهای ویژه کودکان بستری شد.
جدول 1.
| محدوده نرمال | زمان مراجعه به بیمارستان | متغیر |
| خون | ||
| 135–145 | 140 | Sodium (mmol/liter) |
| 3.4–5.0 | 4.1 | Potassium (mmol/liter) |
| 98–108 | 104 | Chloride (mmol/liter) |
| 23-32 | 20 | Carbon dioxide (mmol/liter) |
| 3-17 | 16 | Anion gap (mmol/liter) |
| 5-20 | 17 | Urea nitrogen (mg/dl) |
| 0.30-1.00 | 0.25 | Creatinine (mg/dl) |
| 70-110 | 106 | Glucose (mg/dl) |
| 8.5-10.5 | 5.6 | Calcium (mg/dl) |
| 1.14-1.30 | 0.88 | Ionized calcium (mmol/liter) |
| 1.7-2.4 | 1.9 | Magnesium (mg/dl) |
| 4.5-5.58 | 4.3 | Phosphorus (mg/dl) |
| 142-335 | 673 | Alkaline phosphatase (U/liter) |
| 10-60 | 177 | Parathyroid hormone (pg/ml) |
| ادرار | ||
| – | 46 | Creatinine (mg/dl) |
| – | 19.7 | Calcium (mg/dl) |
| – | 47.8 | Phosphate (mg/dl) |
- مطالعات تصویربرداری
دکتر روت لیم: رادیوگرافی زانوها (شکل 1a و 1b) چندین ناهنجاری را به طور متقارن بر روی زانوها نشان میدهد. استخوانها به طور منتشر رادیولوسنت بوده و قشرهای نازک داشتند؛ این ویژگیها نشاندهندهی دمینرالیزاسیون (demineralization) عمومی است. هیچ شکستگی حاد یا بهبودی مشاهده نشد. متافیز دیستال استخوان ران و پروگزیمال تیبیا دارای یک کانتور (contour) باز و دوطرفه داشت؛ علاوه بر این، جنبه میانی متافیز پروگزیمال استخوان تیبیا یک خط منقار نوک تیز (beaked) را نشان داد. منطقه کلسیفیکاسیون پروویژنال – ناحیهای که بین متافیز و صفحه رشد اولیه رادیولوسنت (فیز) واقع شدهاست، جایی که کندروسیتها مسئول رشد طولی استخوانهای بلند هستند – در ظاهر کم رنگ و با مناطق کانونی cupping (concavity) بود. فیزهای رادیولوسنت بهطور غیرطبیعی در دیستال استخوان ران و پروگزیمال تیبیا بهطور دوطرفه پهن شدند.
از آنجا که در رادیوگرافی زانوها ناهنجاری مشاهده شد، رادیوگرافی قفسه سینه (شکل 1C) برای اطلاعات بیشتر بررسی شد. یافتههای ظریفی وجود داشت، از جمله فلیرینگ و cupping متافیز پروگزیمال استخوان بازو راست و فلرینگ ملایم انتهای قدامی دندهها.
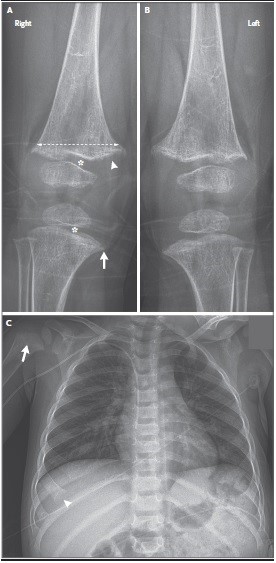
شکل 1.
- تشخیصهای افتراقی
دکتر یامینی وی. ویرکود: در این پسر 29 ماهه با سابقه اگزما و آلرژیهای محیطی و غذایی و سابقه تشنج ناشی از تب 2 ماه قبل، مراجعه نمودهاست. از زمان این تشنج، خانواده متوجه ناهنجاریهای مستمر اندام و راه رفتن شدند. در مراجعه فعلی، بیمار علائمی از تحریکپذیری عصبی-عضلانی یا تتانی داشت؛ از جمله قفل شدن پا و لرزش علاوه بر تشنج؛ یافتههایی که همگی با هیپوکلسمی قابل توجه بالینی مطابقت دارند. وجود این شرایط با مقادیر کم کلسیم و کلسیم یونیزه تأیید شد. سوال اصلی این است: چگونه چنین هیپوکلسمی شدیدی در این پسر 29 ماهه نسبتاً سالم ایجاد شده است؟
- آسیب شناسی
دکتر ویلیام تی روتول: در آزمایش تشخیصی بیمار سطح 25 هیدروکسی ویتامین D کاملاً پایین (4 نانوگرم در میلیلیتر) بود (10 نانومول در لیتر؛ محدوده طبیعی 20 تا 80 نانوگرم در میلی لیتر).
جدول 2.
| محدوده نرمال | روز 12 بستری | روز 7 بستری | هنگام مراجعه | متغیر |
| 8.5-10.5 | 9.9 | 9.0 | 5.6 | Calcium (mg/dl) |
| 1.14-1.30 | 1.27 | 1.20 | 0.88 | Ionized calcium (mmol/liter) |
| 4.5-5.5 | 4.9 | 4.6 | 4.3 | Phosphorus (mg/dl) |
| 142-335 | 429 | 566 | 673 | Alkaline phosphatase (U/liter) |
| 10-60 | 94 | 135 | 177 | Parathyroid hormone, intact (pg/ml) |
| 20-80 | 15 | 10 | 4 | 25-Hydroxyvitamin D (ng/ml) |
| 24-86 | – | 316 | 16 | 1,25-Dihydroxyvitamin D (pg/ml) |
ویتامین D فعال باعث افزایش جذب کلسیم روده، افزایش جذب کلسیم استخوان و کاهش دفع کلسیم در ادرار میشود. همچنین به عنوان تنظیم کننده منفی PTH عمل میکند؛ بنابراین اگر ویتامین D کافی در این بیمار موجود بود، 25هیدروکسی ویتامین D و 1،25دیهیدروکسی ویتامین D به طور مناسب سنتز میشد، کلسیم از استخوان و رژیم غذایی تأمین میشد، دفع فسفات از طریق ادرار کاهش مییافت و سطح PTH و آلکالن فسفاتاز طبیعی بود.
اگرچه 1،25دیهیدروکسی ویتامین D شکل فعال هورمون است، اما در صورت مشکوک بودن به کمبود باید 25هیدروکسی ویتامین D اندازه گیری شود. سطح 25هیدروکسی ویتامین D خون با مصرف ویتامین D و فعالیت آن مطابقت دارد. نیمه عمر 25هیدروکسی ویتامین D، 2 تا 3 هفته است، در مقایسه با نیمه عمر 4 تا 6 ساعته برای 1،25دیهیدروکسی ویتامین D. با این حال، سطح 1،25دی هیدروکسی ویتامین D بسته به سطح ویتامین D ، کلسیم، فسفر و PTH بیمار متغیر باشد. به عنوان مثال، سطح 1،25دی هیدروکسی ویتامین D این بیمار در ابتدا کم بود. هفت روز پس از شروع مصرف ویتامین D ، سطح 1،25دیهیدروکسی ویتامین D بالا بود. این یافته ممکن است به این معنی باشد که بیمار بیش از حد با ویتامین D درمان شده است، در حالی که درواقع همچنان کمبود دارد. در عوض، سطح 1،25دیهیدروکسی ویتامین D ممکن است برای تشخیص ریکتز ژنتیکی یا در زمینه نارسایی مزمن کلیه، هایپرکلسمی غیرقابل توجیه یا هیپرکلسیوری مفید باشد.
- مدیریت بیمار
دکتر دبورا میچل: راشیتیسم تغذیهای اغلب به عنوان یک یادگار تاریخی در نظر گرفته میشود – کشف ویتامین D و اجرای استراتژیهای مکمل و غنیسازی مواد غذایی در اوایل قرن 20 به شدت شیوع این بیماری که قبلا شایع بود را کاهش داد؛ با این حال، به نظر میرسد میزان کمبود ویتامین D در کشورهای با درآمد بالا افزایشیافته و شیوع آن در کشورهای با درآمد کم و متوسط به طور مداوم زیاد است. در یک مطالعه موردی در سال 2015 از متخصصان اطفال کانادا، عوامل خطر راشیتیسم تغذیهای شامل این موارد است: مشخصات دموگرافیک (مهاجرت اخیر)، ویژگیهای فیزیولوژیکی (محتوای ملانین پوست، آلرژی غذایی، چالشهای تغذیهای مرتبط با نارس بودن، تاخیر در رشد و کمبود ویتامین D مادر) و جنبههای رژیم غذایی (کمبود مکمل ویتامین D و محدودیتهای غذایی) و رفتار (عدم قرار گرفتن در معرض آفتاب). لازم به ذکر است این بیمار سه مورد از این عوامل خطر را دارد (آلرژیهای غذایی، کمبود مکمل ویتامین D و محدودیتهای غذایی). بیمارانی که هیپوکلسمی جدی دارند که با علائم شدید (تشنج یا تتانی) همراه است، کلسیم داخل وریدی دریافت میکنند. متأسفانه شواهد محدودی از آزمایشات تصادفی و كنترلشده برای جبران کمبود ویتامین D وجود دارد. در سال 2016، یک هیئت بینالمللی توصیههایی را برای پیشگیری و مدیریت راشیتیسم تغذیهای ارائه داد. دوزها و مدت زمان درمان در جدول 3 بیان شده است.
جدول 3. دوزهای درمانی ویتامین D (به واحد بینالمللی IU)
| دوز توصیه شده روزانه | دوز درمانی تکی | دوز درمانی روزانه، 90 روز | سن |
| 400 | – | 2000 | کمتر از 3 ماه |
| 400 | 50000 | 2000 | 3 تا 12 ماه |
| 600 | 150000 | 3000-6000 | 1 تا 12 سال |
| 600 | 300000 | 6000 | بیشتر از 12 سال |
این پنل، یک استراتژی روزانه را برای به حداقل رساندن خطر هیپرکلسمی توصیه میکند اما همچنین تشخیص داد که یک دوز تکی بالا ممکن است در برخی شرایط عملیتر باشد و بنابراین توصیههایی برای این استراتژی نیز ارائه داد. ویتامین D2 (ارگوکلسیفرول) و ویتامین D3 (کولهکلسیفرول) وقتی در دوزهای روزانه تجویز میشوند، اثر مشابهی دارند. برخی شواهد نشان میدهد که ویتامین D3 در صورت استفاده در یک دوز واحد، اثر بهتری نسبت به ویتامین D2 دارد. علاوه بر این، دریافت کلسیم کافی از طریق کلسیم غذایی یا مکملهای غذایی برای حمایت از بازسازی مجدد استخوان ضروری است. توصیههای فعلی مصرف حداقل 500 میلیگرم کلسیم در روز را بیان میکند؛ اگرچه یک مطالعه نشان میدهد که مصرف 1000 میلیگرم در روز باعث بهبود سریعتر راشیتیسم میشود. مقدار کافی کلسیم همچنین برای پیشگیری از سندرم استخوان گرسنه نیز ضروری است، شرایطی که در پس از شروع درمان با ویتامین D، بدتر شدن متناقض هیپوکلسمی رخ میدهد. تصور میشود که این شرایط به دلیل جذب سریع مواد معدنی استخوان توسط اسکلت باشد. مدیریت این شرایط ممکن است به دوزهای بسیار زیاد کلسیم و همچنین دوزهای درمانی مقطعی کلسیتریول (1،25دی هیدروکسی ویتامین D)، شکل فعال ویتامین D، نیاز داشته باشد.
پاسخ به درمان را میتوان با بهدست آوردن سطح کلسیم، فسفات، 25هیدروکسی ویتامینD ، PTH و آلکالین فسفاتاز و کلسیم ادرار کنترل کرد (نسبت کراتینین تقریبا 4 هفته پس از شروع درمان و در فواصل ماهانه تا رفع ناهنجاریهای آزمایشگاهی). در بیشتر کودکان مبتلا به راشیتیسم تغذیهای، مقادیر آزمایشگاهی معمولا نرمال میشوند و رادیوگرافی پس از 3 ماه درمان کافی بهبود قابل توجهی را نشان میدهد؛ اگرچه برخی از بیماران ممکن است به ادامه درمان نیاز داشته باشند. پیشگیری ثانویه با دوزهای نگهدارنده روزانه ویتامین D (جدول 3) و ادامه حداقل 500 میلی گرم کلسیم در روز باید آغاز شود و به طور نامحدود ادامه یابد.
- تشخیص نهایی
کمبود ویتامین D
- بحث درمورد آلرژی غذایی
خطرات اجتناب از غذا
دکتر ویرکود: پرهیز از غذا غالباً بهعنوان یک مداخله خوشخیم تلقی میشود، اما این بیمار نشان میدهد که حتی محدودیتهای غذایی لازم از نظر پزشکی نیز میتواند عواقب شدیدی داشتهباشد. برای بیماران مبتلا به آلرژی غذایی مشخص به واسطه IgE، اجتناب از غذا از نظر پزشکی ضروری است و با اینحال هنوز هم پیامدهایی دارد که نیاز به نظارت دارد. بسیاری از مطالعات رشد وزنی و قدی کاهشیافته را در بیماران مبتلا به آلرژی غذایی با واسطه IgE و غیر IgE ثبت کردهاند و بزرگترین مطالعه نشانداد که کودکان دارای حساسیت به شیر استعداد ویژهای به کاهش وزن دارند.
رژیمهای غذایی محدود کودکان مبتلا به آلرژی غذایی نه تنها رشد را تحت تأثیر قرار میدهند، بلکه میتوانند منجر به کمبودهای غذایی خاص شوند. در این بیمار، ترکیب محدودیتهای غذایی و رژیم گیاهخواری منجر به از بین رفتن تمام منابع رایج ویتامین D و کلسیم شد. سایر کمبودهای ریزمغذی گزارش شده در کودکان با محدودیت غذایی شامل کمبود ید، اسیدهای چرب مانند n-3 و n-6 (به ترتیب با امگا 3 و امگا 6 نیز شناخته میشوند)، ویتامین A، روی و ویتامینهای گروه B میباشند (شکل 2). كودكان مبتلا به آلرژی غذایی همچنین میتوانند بدغذا باشند (picky eater)، بنابراین به محض حذف مواد حساسیتزای رایج مانند شیر، تخم مرغ، آجیل یا غذاهای دریایی، خطر كمبودهای غذایی به طور چشمگیری افزایش مییابد. والدین ممکن است به متخصصان تغذیه، که میتوانند استراتژیهایی برای ترکیب غذاهای مغذی کمک کنند، نیاز داشته باشند.
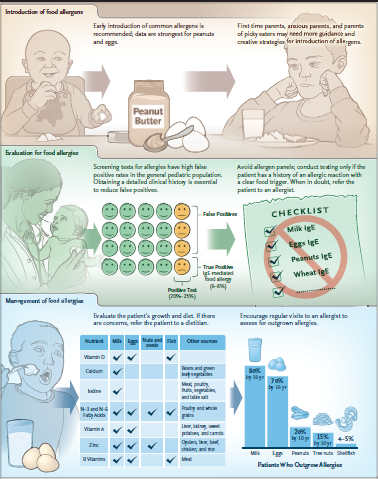
شکل 2.
جلوگیری از تشخیص اشتباه آلرژیهای غذایی
شیوع آلرژیهای غذایی با واسطه IgE و بستری شدن در بیمارستان برای آنافیلاکسی ناشی از مواد غذایی طی چند دهه گذشته در حال افزایش است، اما تخمین دقیق شیوع آن به دلیل تشخیص نادرست آلرژیهای غذایی سخت است.
دقیق ترین ابزار تشخیصی، چالش غذای خوراکی است که در آن بیمار دچار آلرژی غذایی، به تدریج با مقدار افزایشیابندهی آلرژن مشکوک تغذیه میشود. با این حال، این روش وقت گیر بوده، نیاز به منابع داشته و خطر واکنشهای آلرژیک را به همراه دارد؛ بنابراین تشخیص آلرژی غذایی غالباً به سابقه بالینی، آزمایش خراش پوست و آزمایش خون IgE مخصوص آلرژن متکی است. تستهای بالینی و آزمایشگاهی به دلیل ویژگی ضعیف به شدت محدود هستند. به طور متوسط، تست خراط پوستی حساسیت و ویژگی بالاتری نسبت به آزمایش IgE مخصوص آلرژن دارد. برای هردو آزمایش، حساسیت کلی از 55 تا 96% و ویژگی آن از 38 تا 73%، بسته به آلرژن آزمایش شده، متغیر است. با این حال، براساس یک مطالعه از نمونههایی که از جمعیت عمومی کودکان TNHNES گرفته شد، تقریباً 20 تا 25٪ از کودکان آزمایش خون IgE مخصوص مواد حساسیتزای غذایی مثبت دارند، درحالیکه شیوع واقعی آلرژی غذایی با واسطه IgE احتمالاً نزدیک به 6 تا 8٪ باشد. این به معنی میزان بالای مثبت کاذب همراه درمورد استفاده از آزمایش IgE خاص آلرژن برای غربالگری عمومی است.
در این بیمار، وجود آزمایشات مثبت مخصوص شیر، تخم مرغ، مغزهای درختی، بادام زمینی و حبوبات و به دنبال آن، شروع مجدد موفقیتآمیز برخی از این مواد غذایی، نمونهای کلاسیک از محدودیتهای آزمایش تشخیصی در زمینه آلرژی است. یک روش کلیدی برای کاهش تشخیص اشتباه آلرژیهای غذایی شامل پرهیز از استفاده بیرویه از آزمایش خون IgE در غربالگری آلرژیهای غذایی است. پانلهای IgE آلرژن اختصاصی، به ویژه مشکلساز هستند، زیرا آنها اغلب موارد نادرست را کشف می کنند و منجر به اجتناب غیرضروری از غذا میشوند. پس از بهدست آوردن شرححال کامل از واکنش آلرژیک مشکوک، از IgE و آزمایش خراش پوست میتوان به عنوان آزمایشهای تأییدی استفاده نمود و فقط آن دسته از آلرژنهای غذایی را هدف قرار داد که مشکوک به ایجاد واکنش هستند. با توجه به زمانی که برای گرفتن وقت ملاقات با یک متخصص آلرژی به عنوان یک بیمار جدید لازم است، انجام تمام آزمایشات غربالگری لازم و سپس رسیدن به بالای لیست انتظار طولانی برای انجام یک چالش غذای خوراکی، ممکن است بیش از یک سال طول بکشد تا تکلیف یک تست IgE مثبت کاذب مشخص شود. در طول این مدت، بیمار در معرض ابتلا به کمبودهای تغذیهای و همچنین اضطراب در مورد آلرژیهای غذایی است و در واقع حتی ممکن است خطر ابتلا به آلرژی غذایی جدید را افزایش دهد.
روش دیگر برای کاهش شیوع آلرژیهای غذایی شامل پیگیری دقیق با متخصص آلرژی برای شناسایی آلرژیهای outgrown شده است. میزان آلرژی outgrown در شیر و تخممرغ بالاترین است (به ترتیب تقریباً 70٪ و 80٪) و برای آجیل و غذاهای دریایی کمتر است (شکل 2). برای کنترل احتمال آلرژی outgrown، متخصصان آلرژی، تست خراش پوستی و IgE را تکرار میکنند. بر اساس نتایج، متخصصان آلرژی با استفاده از چالش غذای خوراکی در کلینیک یا خانه، شروع مجدد غذا را راهنمایی مینمایند. بسیاری از بیمارانی که از آلرژی رنج میبرند، نسبت به شروع مجدد غذا اضطراب شدیدی دارند و متخصصان آلرژی و روانشناسان میتوانند این روند را راهنمایی کنند. برای بیماران مبتلا به آلرژی غذایی، پیگیری سالانه با متخصص آلرژی برای شروع مجدد غذا در اسرع وقت به منظور کاهش خطرات احتمالی مرتبط با رژیم غذایی غیر ضروری محدود، ضروری است.
متخصصان اطفال و متخصصان آلرژی میتوانند با خودداری از غربالگری IgE، که اغلب نتایج مثبت کاذب را نشان میدهند، و با نظارت دقیق بر بیماران دارای رژیمهای غذایی محدود از نظر کمبودهای تغذیهای و همچنین تشویق بهموقع شروع مجدد مواد آلرژیزا، و با پیگیری منظم بیماران برای حذف هرگونه ماده غذایی با آلرژی outgrown، نقش مهمی در کاهش خطرات داشتهباشند. متخصصان تغذیه و روانشناسان که متخصص مواد غذایی هستند میتوانند در حمایت از این تلاش ها بسیار ارزشمند باشند. سرانجام، همه پزشکان میتوانند در کاهش باورهای غلط والدین و ترس در مورد آلرژی غذایی که اغلب منجر به تأخیر در شروع غذا در نوزادان میشود و همچنین با تشویق خانوادهها برای راهنمایی گرفتن از متخصصان اطفال و آلرژی، نقش داشته باشند.
- پیگیری بیمار
دکتر فرناندس: تا زمانی که سطح کلسیم یونیزه به بیش از 1 میلیمول در لیتر برسد، گلوکونات کلسیم وریدی تجویز شد و همچنین بیمار مکمل خوراکی کلسیم دریافت نمود. برای حفظ پایدار سطح کلسیم یونیزه بیش از 1 میلیمول در لیتر مشکل داشتیم، بنابراین تزریق مداوم کلسیم به مدت 7 روز انجام شد. برای تشخیص زمینهای کمبود ویتامین D، به وی ویتامین D با دوز 50000 واحد در روز 1 و سپس 1000 واحد در روزانه و همچنین کلسیم المنتال با دوز 300 میلیگرم سه بار در روز تجویز شد. در نهایت بیمار با دریافت کربنات کلسیم و ویتامین D مرخص شد. در زمان ترخیص ، سطح کلسیم 9.4 میلیگرم در دسیلیتر (2.35 میلیمول در لیتر)، سطح کلسیم یونیزه 1.25 میلیمول در لیتر، سطح آلکالین فسفاتاز U/Liter 429 و سطح PTH 94 pg در میلیلیتر بود. در آخرین ویزیت وی در کلینیک غدد و درونریز، حال وی خوب بود و تستهای آزمایشگاهی وی نرمال شده بود. در 3 سال و 11 ماهگی، قد او در صدک 19 و وزن او در صدک 69 بود. او چالشهای غذایی برای چندین ماده حساسیتزا که در مطب انجام شد را به موفقیت پشتسر گذاشت اما مصرف شیر، تخم مرغ و آجیلهای درختی همچنان محدود شد.




